Questões de Concurso
Sobre termodinâmica: energia interna, trabalho, energia livre de gibbs e entropia em química
Foram encontradas 111 questões
Dados: ΔH°fus = 6.025 J/mol e temperatura de fusão do gelo é de 0 °C.
O valor de ΔS°fus relacionado à fusão do gelo em água é:
Os valores de q, w, ΔH e ΔU são, respectivamente:
I. Quanto mais forte o ácido, mais positivo o valor de ∆Gº para a dissociação.
II. Quanto mais forte o ácido, mais negativo o valor de ∆Gº para a dissociação.
III. Quando o ∆H é positivo, a reação ocorre com absorção de calor.
IV.Quando o ∆H é negativo, a reação ocorre com absorção de calor.
A alternativa com a sequência correta é:
I - Em um processo isotérmico, a variação da energia interna de um gás ideal é zero.
II - A entropia do universo sempre aumenta em processos espontâneos.
III - A variação da energia livre de Gibbs é igual ao trabalho máximo não-expansivo que pode ser realizado por um sistema à temperatura e pressão constantes.
IV - Para qualquer processo em um sistema isolado, a variação de entropia é sempre maior que zero.
V - A entalpia de uma reação endotérmica é sempre positiva.
É CORRETO concluir o que se afirma em:
Um dos métodos mais comuns envolve a oxidação do metal cobre em presença de ar. São conhecidas a 298K, as seguintes entalpias e entropias a T e P constantes:

Em relação ao óxido de cobre, assinale a afirmativa correta.
Em relação aos processos de tratamento de lodos ativados e digestores anaeróbicos, assinale a afirmativa correta.
Com base nessas informações assinale a afirmativa correta acerca da espontaneidade do processo e da variação de energia livre de Gibbs ΔG.

Com relação às diferentes etapas do ciclo, avalie as afirmativas a seguir:
I. A etapa de A para B se caracteriza por uma expansão isocórica.
II. A etapa de B para C se caracteriza por uma compressão adiabática.
III. A etapa de C para D se caracteriza por uma expansão isotérmica.
IV. A etapa de D para A se caracteriza por uma compressão isocórica.
Está correto o que se afirma em
2NO2(g) ⇌ N2O4(g) ΔH = - 57 kJ/mol
Durante o processo, observou-se que a cor do sistema se torna menos intensa em determinadas condições, indicando uma mudança na concentração dos compostos. A empresa deseja maximizar a formação de N2O4 e, para isso, é necessário realizar ajustes precisos nas condições de equilíbrio. Considerando o exposto e os princípio de Le Chatelier, assinale a afirmativa correta.
I. Nas células eletrolíticas, a energia química é convertida em energia elétrica.
II. Assim como a entropia, processos espontâneos são acompanhados por uma variação positiva na energia de Gibbs (∆G).
III. Ao multiplicar por dois a semirreação “Fe2+(aq) → Fe3+(aq) + e- ; E°= – 0,77V”, o valor do potencial padrão não deverá ser alterado.
Está correto o que se afirma apenas em
Assinale a alternativa que preenche, correta e respectivamente, as lacunas do trecho acima.
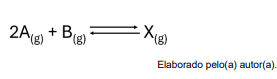
Segundo o principío de Le Chatelier, a alteração no sistema que deve ser feita para que equilíbrio favoreça a formação de reagentes é
Use: Ered Sn2+ = -0,14V , Ered Cu2+ = +0,34 V e F = 96485,33 C.mol-1