Questões de Concurso
Sobre termodinâmica: energia interna, trabalho, energia livre de gibbs e entropia em química
Foram encontradas 111 questões
Com relação à termoquímica, à entropia, à espontaneidade de reações e à cinética química, julgue o item.
Entropia é a quantidade termodinâmica da medida do
grau de desordem em um sistema, sendo que a variação
de entropia é igual ao calor fornecido reversivelmente a
um sistema, multiplicado pela temperatura em que a
transferência de calor ocorre na vaporização, conversão
da substância do estado líquido para o estado de vapor.
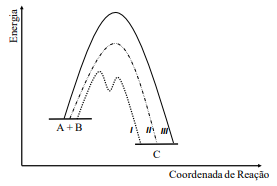
Assinale a alternativa INCORRETA.
Por exemplo, em um processo adiabático, o fluxo de calor durante a mudança de estado é nulo, ao passo que:
A partir da 2ª Lei da Termodinâmica o conceito
de entropia foi criado, a fim de explicar a direção de
um processo ou transformação. Sendo assim, a
entropia total é uma medida de desordem que:
Sabendo que um sistema fechado realiza 520 kJ de trabalho e perde 220 kJ de energia na forma de calor, é correto afirmar que:
Considere a célula eletroquímica abaixo.
A diferença de potencial elétrico da célula é dada por: E= 0,5580 + 0,05916 log([Ag+]), em Volts.
Na titulação de 30mL de uma solução de KCI 0,4M foi usada uma solução de AgNO3 0,15M. Sabendo que a diferença de potencial elétrico foi medida pela célula acima, assinale a opção que apresenta o valor da diferença de potencial elétrico, em Volts, após a adição de 20ml da solução de AgNO3.
Dado: KPS,AgCI = 1,8 x 10-10
A respeito de um sistema adiabático, são dadas as seguintes sentenças:
I- A temperatura no interior do sistema adiabático é constante.
II- Em um processo de expansão adiabática, ocorre um aumento no volume e diminuição na pressão.
III- A energia interna, para um processo de compressão adiabática, é igual à soma das energias na forma de calor e do trabalho realizado sobre o sistema.
É correto o que se afirma em:
3 Cuo(s) + 8 HNO3(aq) → 3 Cu(NO3)2(aq) + 2 NO(g) + 4 H2O(l) (1) 2 NO(g) + O2(g) → 2 NO2(g) (2) NO2(g) ⇌ N2O4(g) (3)
Isso posto, considerando um sistema transparente e fechado, o produto NO2(g) apresenta coloração marrom. O produto N2O4(g) é um gás incolor e, quando o sistema é aquecido acima da temperatura ambiente, o sistema apresenta uma coloração marrom (forte). Em relação à equação três, referente à formação do N2O4(g), é correto afirmar que:
Reação 1: ΔH1 = +15,3 kJ/mol e ΔS1 =+30 J/K.mol Reação 2: ΔH2 = +1,8 kJ/mol e ΔS2 =-159 J/K.mol.
Escolha a alternativa que representa os valores de ΔG1 e ΔG2 em kJ/mol, respectivamente, e as previsões corretas de espontaneidade ou não espontaneidade da reação nessa temperatura:
A respeito da energia livre de Gibbs, quando um processo ocorreu à pressão e temperatura constantes, um químico fez as seguintes ponderações:
I. Se a variação da energia livre de Gibbs for negativa, a reação química será espontânea num sentido direto da equação química. II. Se a variação da energia livre de Gibbs for nula, a reação química será não espontânea num sentido direto da equação química. III. Se a variação da energia livre de Gibbs for positiva, a reação inversa será espontânea.
Estão corretas as ponderações
dentifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ).
( ) De acordo com o princípio da conservação da energia, a energia não pode ser criada nem destruída, mas somente transformada de uma espécie em outra.
( ) O estado de equilíbrio químico ocorre no momento em que o sistema reacional estaciona e a reação é completada.
( ) Aproximadamente 1,3 kW m-2 da energia radiante solar atinge a Terra, porém somente cerca de 5% desta energia é convertida em carboidratos pela fotossíntese.
( ) Denomina-se “processo exotérmico” aquele que absorve calor e apresenta ∆H > 0.
( ) Aumentar a quantidade dos reagentes é a única maneira de se elevar o valor da constante de equilíbrio de uma reação química.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
No que se refere à termoquímica, a reações exotérmicas e endotérmicas e à variação de entalpia, julgue o item
O calor absorvido durante um processo a volume
constante, em que nenhum trabalho de expansão pode
ser realizado, é igual à variação da energia do sistema.
