Questões de Concurso
Sobre termodinâmica: energia interna, trabalho, energia livre de gibbs e entropia em química
Foram encontradas 111 questões
Assinale a alternativa que indica a variação de entropia da reação/formação de amônia, em J/K.
N2(g) + 3H2(g) → 2NH3(g)
Admita as seguintes entropias molares: Som (N2) = 191,6 J/K, Som (H2) =130,7 J/K e Som (NH3) = 192,4 J/K
A primeira lei da termodinâmica define a conservação da energia, e a segunda lei estabelece os fundamentos para a compreensão da espontaneidade dos fenômenos na natureza. A grandeza central na qual a segunda lei é estabelecida é a
2 POCl3(g) → 2 PCl3(g) + O2(g)
Nas condições-padrão a 298 K, a variação de entalpia (ΔH0 ) e a variação de entropia (ΔS 0 ) para esse processo valem, respectivamente, 572 kJ e 179 J/K. A partir das informações apresentadas, analise as afirmações a seguir.
I. O processo de decomposição do cloreto de fosforila é endotérmico. II. O processo leva à diminuição da desordem do sistema. III. O processo é não-espontâneo nas condições-padrão.
Está correto apenas o que se afirma em
Considerando-se a usina como um sistema termodinâmico, nele ocorre um processo
Esse processo químico
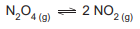
O valor da avaliação de Energia Livre de Gibbs da reação (∆Gr º ) é

Nessas condições, o valor da energia livre de Gibbs padrão da reação, em kJ mol-1, é mais próximo de
Dado
Constante de Faraday (F) = 96500 C mol-1
Em um equipamento de proteção radiológica, uma peça de 0,7 kg de chumbo tem sua temperatura elevada de 30ºC para 70ºC ao receber uma determinada quantidade de calor.
Sendo o calor específico do chumbo igual a 130 J kg-1
K-1
,
a quantidade de calor, em joules, recebida pela peça é
igual a
No que se refere aos fundamentos dos métodos espectroscópicos de análise, julgue o próximo item.
Existem duas limitações instrumentais importantes para a
Lei de Beer-Lambert: essa lei é estritamente válida para
radiações monocromáticas puras, o que é muito difícil de
conseguir; e radiações de fundo, originadas por imperfeições
no seletor de comprimento de onda, podem atingir o
detector. Essas limitações são as principais causas dos
desvios da Lei de Beer-Lambert.
Acerca do equilíbrio em células galvânicas, julgue o próximo item.
A equação de Gibbs, ΔG = ΔGº + RT lnQ, traduz a
dependência da tensão imposta a células eletroquímicas em
relação às concentrações das espécies envolvidas.
No que se refere à entropia e ao terceiro princípio da termodinâmica, julgue o item seguinte.
Considere um gás ideal com capacidade calorífica constante de ÿ passando por um processo reversível adiabático. Nesse caso, a razão entre as temperaturas inicial e final, T1 e T2, e as pressões inicial e final, P1 e P2, desse sistema pode ser corretamente escrita pela seguinte fórmula.
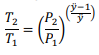
No que se refere à entropia e ao terceiro princípio da termodinâmica, julgue o item seguinte.
Para um sistema irreversível, a entropia pode ser escrita,
matematicamente, como a quantidade de calor dividida pela
temperatura.
No que se refere à entropia e ao terceiro princípio da termodinâmica, julgue o item seguinte.
Considere que um molde de aço de 40 g, com capacidade
calorífica à pressão constante cp = 0,5 kJ · kg−1
· K−1
,
inicialmente a 450 ºC, tenha sido resfriado em um óleo com
capacidade calorífica à pressão constante
cp = 2,5 kJ · kg−1
· K−1
, inicialmente a 25 ºC. Nessa situação,
a variação de entropia será superior a +16 kJ/K,
considerando-se a ausência de perdas térmicas.
Com relação à espontaneidade e ao segundo princípio da termodinâmica, julgue o item que se segue.
Reações químicas espontâneas têm maior probabilidade de
ocorrência em sistemas isentrópicos.
Com relação à espontaneidade e ao segundo princípio da termodinâmica, julgue o item que se segue.
Em sistemas reais, o balanço de entropia é um fator
importante no cálculo dos trabalhos real e ideal.
Com relação à espontaneidade e ao segundo princípio da termodinâmica, julgue o item que se segue.
Uma reação química com variação de entropia negativa e
variação de entalpia positiva é espontânea.
No que diz respeito a energia e ao primeiro princípio da termodinâmica, julgue o item a seguir.
Um processo será reversível quando seu sentido puder ser
revertido em qualquer ponto do processo por uma variação
infinitesimal das condições externas.
No que diz respeito a energia e ao primeiro princípio da termodinâmica, julgue o item a seguir.
Considerando-se a aceleração da gravidade como igual a
9,8 m/s2
, é correto afirmar que a energia potencial de 1 kg de
água, no topo de uma queda de água de 100 m em relação à
sua base, vale 980 J.