Questões de Química - Termodinâmica: Energia Interna, Trabalho, Energia Livre de Gibbs e Entropia para Concurso
Foram encontradas 98 questões
Segundo a Primeira Lei da Termodinâmica, que se refere à conservação da energia, Δu = t, em que Δu é a variação da energia e t é o trabalho realizado.
O teorema da equivalência do trabalho com a energia mecânica é um conceito importante em mecânica, mas que não tem relevância na termodinâmica.
Com relação à termodinâmica em geral, às suas leis e unidades e aos mecanismos de transferência de calor, julgue o item a seguir.
Considere que, para gases ideais monoatômicos, tenha foi proposta sido proposta a expressão a seguir para a divisão da entropia S pelo número de partículas (s = S/N).
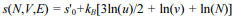
Nessa expressão, u é a energia U pelo número de partículas
(u = U/N) e v é o volume V pelo número de partículas (v =
V/N). Nesse caso, tal expressão apresenta uma inadequação,
pois a entropia, assim escrita, não obedece à propriedade de
ser uma quantidade extensiva
Com relação à termodinâmica em geral, às suas leis e unidades e aos mecanismos de transferência de calor, julgue o item a seguir.
Conforme a Segunda Lei da Termodinâmica, para
fenômenos macroscópicos ou microscópicos, a entropia
sempre aumenta ou permanece a mesma.
Com relação à termodinâmica em geral, às suas leis e unidades e aos mecanismos de transferência de calor, julgue o item a seguir.
No Sistema Internacional de Unidades (SI), a unidade de
calor é o joule, representado pela letra J, sendo 1 J
equivalente a 1 kgf∙m (isto é, 1 quilograma-força
multiplicado pelo metro).
Com relação à termodinâmica em geral, às suas leis e unidades e aos mecanismos de transferência de calor, julgue o item a seguir.
Entre os mecanismos de transmissão de calor, o único que
pode ocorrer no espaço vazio é a radiação, que consiste em
ondas eletromagnéticas que se propagam na velocidade da
luz.
Com relação à termodinâmica em geral, às suas leis e unidades e aos mecanismos de transferência de calor, julgue o item a seguir.
Na situação ilustrada na figura a seguir, as letras A, B e C indicam, respectivamente, os fenômenos de condução, de convecção e de radiação.
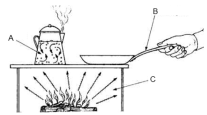
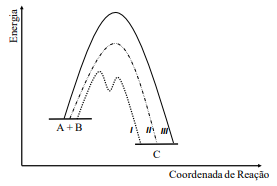
Assinale a alternativa INCORRETA.
Por exemplo, em um processo adiabático, o fluxo de calor durante a mudança de estado é nulo, ao passo que:
I. Se a variação da energia livre de Gibbs for negativa, a reação química será espontânea num sentido direto da equação química. II. Se a variação da energia livre de Gibbs for nula, a reação química será não espontânea num sentido direto da equação química. III. Se a variação da energia livre de Gibbs for positiva, a reação inversa será espontânea. Estão corretas as ponderações
A partir da 2ª Lei da Termodinâmica o conceito
de entropia foi criado, a fim de explicar a direção de
um processo ou transformação. Sendo assim, a
entropia total é uma medida de desordem que:
Sendo assim, se um sistema realiza 25 J de trabalho e recebe 43 J de calor, é CORRETO afirmar que a variação de energia interna para esse processo é igual a:
A respeito de um sistema adiabático, são dadas as seguintes sentenças:
I- A temperatura no interior do sistema adiabático é constante.
II- Em um processo de expansão adiabática, ocorre um aumento no volume e diminuição na pressão.
III- A energia interna, para um processo de compressão adiabática, é igual à soma das energias na forma de calor e do trabalho realizado sobre o sistema.
É correto o que se afirma em:
3 Cuo(s) + 8 HNO3(aq) → 3 Cu(NO3)2(aq) + 2 NO(g) + 4 H2O(l) (1) 2 NO(g) + O2(g) → 2 NO2(g) (2) NO2(g) ⇌ N2O4(g) (3)
Isso posto, considerando um sistema transparente e fechado, o produto NO2(g) apresenta coloração marrom. O produto N2O4(g) é um gás incolor e, quando o sistema é aquecido acima da temperatura ambiente, o sistema apresenta uma coloração marrom (forte). Em relação à equação três, referente à formação do N2O4(g), é correto afirmar que:
4Aℓ(s) + 3O2(g) → 2Aℓ2O3(s)
