Questões de Concurso
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 453 questões
Os valores de q, w, ΔH e ΔU são, respectivamente:
Considere o equilíbrio químico abaixo:
PCl5 (g) ⇋ PCl3(g) + Cl2 (g) ΔH = 87,9 kJ
Sobre a reação acima, analise as assertivas a seguir:
I. A diminuição da temperatura desloca o equilíbrio no sentido dos produtos, favorecendo a formação de PCl3.
II. O aumento da pressão desloca o equilíbrio no sentido dos produtos.
III. A adição de um catalisador aumenta o valor da constante de equilíbrio (Kc) e acelera a reação direta e inversa.
Quais estão corretas?

Dados: C (12 g.mol-1), O (16 g.mol-1) e H (1 g.mol-1)
Ao analisar os dados da tabela, qual é o calor liberado na combustão completa de 5L de etanol (densidade 0,80 g.mL-1) presentes em um automóvel?
Qual a entalpia de hidrogenação do eteno, em kJ.mol-1, tendo em vista que a entalpia de formação do eteno é 52,26 kJ.mol-1 e a do etano é -84,68 kJ.mol-1?
CaCO3 (s) → CaO (s) +CO2 (g) ΔH=+178kJ/mol
Com base nessa reação e nos conceitos de termoquímica, analise as assertivas abaixo:
I. Como a reação é endotérmica, a energia dos produtos é maior do que a energia dos reagentes.
II. Se 2 moles de carbonato de cálcio forem decompostos, a energia absorvida será de 356 kJ.
III. A decomposição do carbonato de cálcio será favorecida a baixas temperaturas, segundo o princípio de Le Chatelier.
IV. Se essa reação ocorresse no sentido inverso, o ΔH seria -178kJ, caracterizando uma reação exotérmica.
Quais estão corretas?

A partir das entalpias de formação, qual a entalpia de combustão do metano?
1. Oxidação da amônia para formar óxido nítrico.
2. Oxidação do óxido nítrico para formar dióxido de nitrogênio.
3. Dissolução do dióxido de nitrogênio em água para formar ácido nítrico.
Considerando essas reações, um rendimento global de 85% em todo o processo, e massas molares dos elementos H: 1,01 g/mol, N: 14,01 g/mol e O: 16,00 g/mol; a massa de amônia necessária para produzir 1 kg de ácido nítrico é de aproximadamente:
C6H12O6 → 2C3H6O3 glicose ácido lático
Essa reação apresenta uma variação de entalpia, a 25 °C, igual a −21 kcal/(mol de glicose) e a reação de combustão total de ácido lático apresenta uma entalpia padrão de combustão igual a −326 kcal/(mol de ácido lático)
A partir dessas informações, a entalpia padrão de combustão da glicose em kcal/(mol de glicose) é
C2H2(g) + O2(g)⟶ CO2(g)+ H2O(g)
Sabendo que a combustão de 1 mol de acetileno libera aproximadamente 1300 kJ de energia, a quantidade de calor liberada na combustão completa de 52 g de acetileno é de aproximadamente
I. É uma propriedade extensiva. Portanto, a magnitude do ∆H é diretamente proporcional à quantidade de reagente consumida no processo.
II. A variação de entalpia para uma reação depende do estado dos reagentes e dos produtos.
III.A variação de entalpia para uma reação é igual em valores absolutos, mas oposta em sinais para o ∆H da reação inversa.
Está correto o que se afirma em
Na matriz energética nacional, a participação das fontes fósseis passou de 9% em 2000, para 14% em 2020. O crescimento se dá, principalmente, por dois fatores: aumento da demanda por energia, que não foi acompanhada pela oferta, e as repetidas crises hídricas no país.
(Adaptado de CNN, 02/07/2022)
Com relação às transformações de energia e às termoelétricas, analise os itens a seguir:
I. O combustível usado em uma usina termelétrica a gás natural é renovável, pois o biogás usado é oriundo da fermentação do lixo orgânico.
II. Em uma usina termoelétrica a gás natural, as transformações de energia são de química para térmica, desta para energia cinética e, por fim, para energia elétrica.
III. A energia não pode ser destruída, embora possa ser criada e transformada.
Está correto o que se afirma em
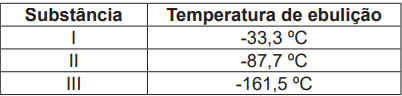
Fonte: ATKINS, P.; JONES, L.; LAVERMAN, L. Princípios de Química: Questionando a vida moderna e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018. p.191.
Considerando a relação existente entre as interações intermoleculares e a temperatura de ebulição, e comparando a temperatura de ebulição das três substâncias, assinale a alternativa que identifica, corretamente, a fórmula química das substâncias I, II e III. São dados os números atômicos dos elementos químicos H (Z=1), C (Z=6), N (Z=7) e P (Z=15).
Acerca das transformações da matéria, julgue o item seguinte.
As reações químicas que liberam a energia na forma
de calor são denominadas reações endotérmicas.
Já as reações que retiram o calor do ambiente são
denominadas reações exotérmicas.