Questões de Concurso
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 453 questões
A formação de amônia pode ser realizada pela reação entre o gás nitrogênio e o gás hidrogênio, conforme a equação química a seguir.
N2 (g) + H2 (g) → NH3 (g) ΔH = −92 kJ
Para essa reação, o valor negativo da variação de entalpia indica que a reação é fortemente endotérmica, com a liberação de 92 kJ de energia.
A quantidade de calor transferido de um objeto mais quente para outro mais frio independe da quantidade de material presente. Também não há qualquer dependência desse processo com a identidade do material que ganha e do material que perde calor.
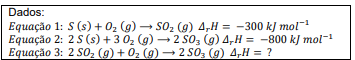
Um químico observa que, durante a dissolução de um certo sal em água, o recipiente em que a solução está sendo preparada se resfria.
A explicação química mais coerente para esse fenômeno é:
O metano (CH4) é um gás produzido durante o processo natural de digestão dos alimentos pelos rebanhos bovinos. A relevância desse gás, considerado fundamental na estratégia de mitigação do aquecimento global, se reflete no fato de o Brasil ter aderido ao Pacto Mundial do Metano na COP26, realizada na Escócia em 2021, se comprometendo a reduzir sua emissão.
Na combustão completa do metano, ele reage com oxigênio (O2) e produz gás carbônico (CO2) e água (H2O).
Disponível em: <https://www.embrapa.br/busca-de-noticias/-/noticia/73172252/nova-metodologia-mede-emissao-de-metano-em-reprodutores-bovinos#:~:text=equipamento%20no%20dorso),
Emiss%C3%A3o%20de%20metano%20%C3%A9%20decorrente%20do%20processo%20de%20digest%C3%A3o%20dos,digest%C3%A3o%20dos%20alimentos%20pelos%20animais>. (Com adaptações) Acesso em: 17 abr. 2024.
Dados:
Substância ΔHf0 (KJmol-1)
CH4(g) -74,8
CO2(g) -393,5
H2O(l) -285,8
Assinale a alternativa que apresenta o calor liberado pela combustão completa de oito gramas de gás metano.
Considere que a reação ocorre em condições padrão.
Calcule a variação da entalpia (ΔH) para a reação global de formação de 0,325 ton calcita a partir de seus elementos constituintes utilizando as reações e os dados termodinâmicos fornecidos a seguir.
Use: Massa molar O = 16 g.mol-1,
I) C(s) + O2(g) ➔ CO2(g) ∆ H = -393,5 kJ mol-1
II) CaO(s) ➔ Ca(s) + 1/2O2(g) ∆H = +635,0 kJ mol-1
III) CaO(s) + CO2(g) ➔ CaCO3(s) ∆H = -178,3 kJ mol-1
Leia o texto a seguir.
“Em química, entretanto, a maior parte das reações químicas ocorre em recipientes abertos para a atmosfera e, portanto, em pressão constante de cerca de 1 atm. Esses sistemas podem se expandir ou contrair livremente. Se um gás se forma, ele trabalha contra a atmosfera para ocupar espaço. Embora nenhum pistão esteja envolvido, trabalho é realizado. Nesse sentido, uma função de estado que medisse as variações de energia em pressão constante considerando automaticamente as perdas de energia como trabalho de expansão durante a transferência de calor seria muito útil.”
ATKINS, Peter; LAVERMAN, Leroy; JONES, Loretta. Princípios de química: questionando a vida moderna e o meio ambiente. 7. Porto Alegre: Bookman, 2018. [Adaptado].
A função de estado à qual o trecho grifado no texto faz
referência é a
C10H8 + O2 → CO2 + H2O
Considerando que uma massa m de naftaleno foi queimada em uma bomba calorimétrica (V constante) de capacidade calorífica Cc, (J/°C), indicando uma variação de temperatura Δt (°C), e que os gases são ideais e o volume dos sólidos e líquidos é desprezível, assinale a alternativa que apresenta corretamente a expressão da variação de entalpia de combustão (ΔH) do naftaleno.
Dados: MM (naftaleno) = 128 g/mol; P = pressão (kPa); V = volume (L); R = constante universal dos gases perfeitos (J/mol.K); T = temperatura absoluta (K); e ΔH = ΔU + (PV), em que ΔU é a variação da energia interna do sistema (J).
Considere as seguintes equações termoquímicas:
1. 2H2 + O2 → 2H2O; ∆H = - 600 kJ/mol
2. C + O2 → CO2; ∆H = - 400 kJ/mol
3. C + 2H2 → CH4; ∆H = + 75 kJ/mol
Qual o ∆H da reação CH4 + 2O2 → CO2 + 2H2O?
Leia o caso a seguir.
Em um dia frio, J. decide preparar um café quente para se aquecer. Utilizando um método tradicional, J. aquece água em um fogão até ferver (100 °C) e, em seguida, a despeja em uma caneca contendo café moído. A mistura de água quente e café resulta em uma bebida com temperatura final específica.
Informações adicionais:
• Massa da água: 100 g;
• Temperatura inicial da água: 100 °C;
• Massa do café moído: 50 g;
• Temperatura inicial do café moído: 25 °C;
• Calor específico da água: 4 J/g·°C;
• Calor específico do café moído: 2 J/g·°C;
• Assume-se que não há perda de calor para o ambiente durante o processo de mistura.
Com base nos conceitos de termoquímica e nos princípios
da conservação da energia, qual é a temperatura final da
mistura de café?
Acerca da termoquímica, julgue o item subsequente.
Uma reação reversível que seja exotérmica em um sentido
será endotérmica no sentido oposto; se uma reação química
libera calor, ela é exotérmica; se, durante uma reação
química, calor é absorvido do meio, então a reação em
questão é endotérmica.
Acerca da termoquímica, julgue o item subsequente.
O valor calorífico de um combustível é medido a partir do
calor de absorção que ele apresenta.
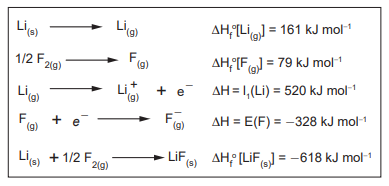
Nesse contexto, o valor aproximado da entalpia de rede (ΔHrede) para o LiF(s), em kJ mol-1 , é

Internet:<www.tabelaperiodica.org>
Acerca da espectroscopia de absorção molecular no ultravioleta e no visível, julgue o item.
À medida que o número de moléculas capazes de absorver luz de um determinado comprimento de onda aumenta, a extensão dessa absorção diminui, de acordo com a Lei de Lambert‑Beer expressa pela equação a seguir.
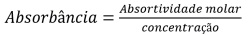

Internet:<www.tabelaperiodica.org>
Em relação à termodinâmica química, julgue o item.
A entalpia não é uma função de estado, o que significa
que sua variação depende do caminho percorrido, e
não apenas dos estados inicial e final.