Questões de Concurso
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 453 questões
C3H8(g) + 5 O2(g) ⇌ 3 CO2(g) + 4 H2O(l) ΔHc° = 2.220 kJ
Tendo as informações precedentes como referência inicial, julgue o próximo item.
A entalpia de formação do propano pode ser obtida pela diferença entre ΔHc° e a soma das entalpias padrão de formação dos produtos da reação de combustão mostrada.
Calcule a variação de entalpia quando 72 g de gelo se fundem.
Considere: ΔH fus= 6009,5 J/mol
H0 = pKa(BH+) - log [BH+] / [B]
onde B é um indicador básico, BH+ é o ácido conjugado desse indicador e pKa(BH+) é a constante de acidez deste último. Quando o indicador é nitroanilina (C6H6N2O2), experimentos realizados para ácidos puros nas mesmas condições, permitem construir a tabela abaixo:
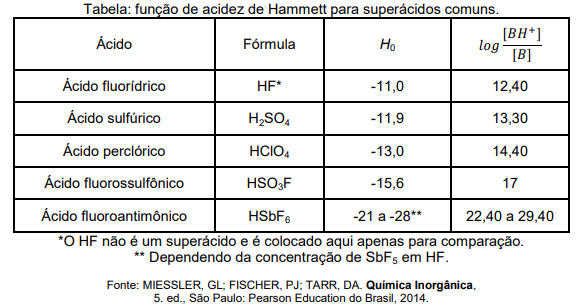
Diante dessas informações, assinale a opção que mostra a ÚNICA reação termodinamicamente espontânea entre pares das substâncias citadas acima:
A variação de entalpia da reação de produção do carbureto de cálcio é igual a
Dados: Massas molares (g.mol-1 ): H=1; C =12; N=14.
A variação de entalpia da reação apresentada, em kJ, é
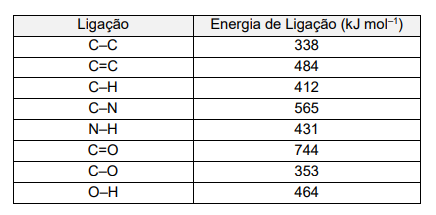
A tabela a seguir apresenta os valores de energias das ligações:
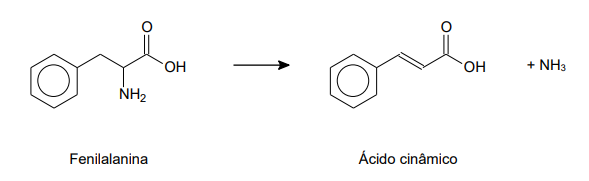
Utilizando os valores das energias das ligações fornecidos, a variação de entalpia envolvida na transformação da fenilalanina em ácido cinâmico representada, em kJ mol-1 , corresponde a:
No que se refere às escalas de temperatura, julgue o item subsequente.
A temperatura pode ser determinada por uma escala
padronizada, equivalente ao conceito de energia do
movimento molecular. O zero absoluto é uma temperatura
em que o movimento das moléculas cessa, sendo esse valor,
na escala absoluta, ou escala Kelvin, igual a −273 K. Na
escala Kelvin, a temperatura absoluta é inversamente
proporcional à energia cinética média de translação das
moléculas de um gás.
Com relação à termoquímica, julgue o item que se segue.
A termoquímica é o ramo da química que estuda os calores
de reações e assuntos relacionados. As reações químicas
endotérmicas ocorrem com libertação de calor, ao passo que
as reações exotérmicas ocorrem com absorção de calor. Os
produtos da queima de combustíveis ao ar são muito quentes,
assim, tal reação é fortemente endotérmica, pois a
temperatura dos produtos é mais elevada que a dos
reagentes.
Com relação à termoquímica, julgue o item que se segue.
A combustão é uma reação química em que a substância
simples ou o composto queima na presença de oxigênio,
produzindo-se CO2 e H2O. Nesse sentido, somente
substâncias orgânicas sofrem combustão.
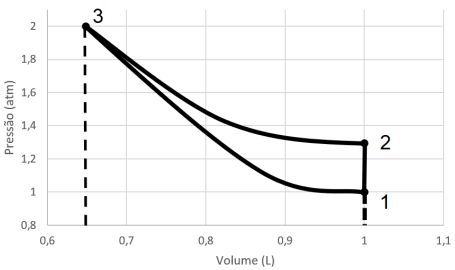
Considerando os aspectos termoquímicos, julgue o item que se segue.
Segundo a Lei de Hess, a avaliação de entalpia de uma
reação independe do estado inicial dos reagentes e do estado
final dos produtos.
Considere os dados termoquímicos:
B2H6(g) + 3 O2(g) → B2O3(s) + 3 H2O(g) ΔHo= -1941 kJ mol–1 2 B(s) + 3/2 O2(g) → B2O3(s) ΔHo= -2368 kJ mol–1 H2(g) + 1/2 O2(g) → H2O(g) ΔHo= -241,8 kJ mol–1
A entalpia padrão de formação do diborano (em kJ mol–1) é
Considere as seguintes equações de reação:
I. N2 (g) + 3Cl2 (g) → 2NCl3 (g) ΔHº > 0
II. N2 F4 (g) → 2NF2 (g) ΔHº > 0
A respeito da espontaneidade dessas reações, é correto afirmar que
Uma reação química, com variação de energia livre de Gibbs negativa, é uma reação
Observe o fenômeno representado pela equação química a seguir.
H2O(l) → H2O(g)
Esse processo pode ser classificado como fenômeno
