Questões de Concurso
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 453 questões
No calorímetro da figura abaixo, que opera em volume constante, 1000 moléculas de glicose foram queimadas.
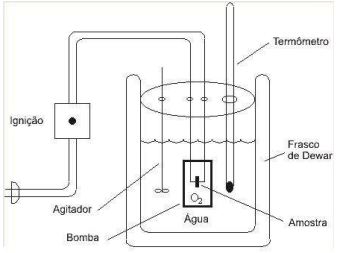
Figura: Bomba Calorimétrica. https://www.ebah.com.br/content/ABAAABOZIAG/bomba-calorimetrica
O calor do processo foi da ordem de 6397,5 KJ em temperatura igual a 25 °C. Dados: R = 8,314 JK-Mol- A variação de entalpia nesta reação foi igual a
Dados das massas molares em g.mol-1 : C = 12 e O = 16.
Quando, no estado gasoso, um átomo neutro de cloro absorve energia e perde um elétron, ocorre a formação de íon Cl+(g) de acordo com a equação abaixo:

A energia absorvida é definida como:
A hidrazina se decompõe em gás nitrogênio e gás hidrogênio, segundo a equação abaixo.
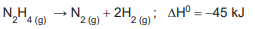
Em relação à sua vizinhança, ao decompor e formar produtos, esse sistema reacional
A decomposição da água é representada na reação termoquímica abaixo.
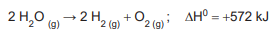
A variação de entalpia, em kJ, de formação de 1 mol de
H2
O(g) será de
FeO(s) + CO(g) → Fe(s) + CO2(g) ∆H = x
Utilizando as equações termoquímicas abaixo e baseando-se na Lei de Hess,
Fe2O3(s) + 3 CO(g) → 2 Fe(s) + 3 CO2(g) ∆H = -25 kJ 3 FeO(s) + CO2(g) → Fe3O4(s) + CO(g) ∆H = -36 kJ 2 Fe3O4(s) + CO2(g) → 3 Fe2O3(s) + CO(g) ∆H = +47 kJ
Partindo de 1 tonelada de óxido ferroso a energia liberada será de aproximadamente quantos kJ?
C6H14 + O2 → CO2 + H2O
Dados os valores de entalpia de ligação:
LIGAÇÃO ΔHo (kJ/mol) C - H 413 C - C 347 C = O 804 H - O 464 O - O 469
Marque a alternativa que apresenta o valor da combustão de 10g do hexano aproximadamente:
C3H8 (g) + O2 (g) → CO2 (g) + H2O (l)
Considerando os dados apresentados na tabela a seguir, o calor de combustão (ΔH) de 0,5 mol de propano será:
Composto ΔHf° (kJ mol-1) C3H8 - 103,8 CO2 - 393,5 H2O - 285,8 Fonte: Novais (2016).
Considere a curva térmica a seguir.
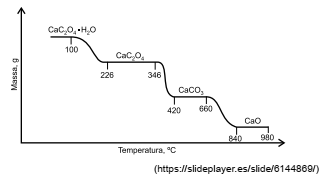
A escolha da temperatura de calcinação na análise gravimétrica leva em conta a conversão do analito em uma
forma de pesagem conhecida e estável. Analisando a
curva térmica para o oxalato de cálcio hidratado, a calcinação a 500 ºC, até que não se observe variação de
massa, leva à formação de
A decomposição por aquecimento de certa mistura contendo CaCO3, NaHCO3 e material inerte não volátil produz gases e 640g de resíduo seco. Sabendo-se que a quantidade de calor absorvida na decomposição é 298 kcal, a percentagem de material inerte presente na mistura inicial é de:
Dados:
-Na=23 // Ca=40.
-Calores de decomposição do:
a) CaCO3 = 44,0 kcal.
b) NaHCO3 = 15,5 kcal com formação de H2O(g).
Considere a seguinte reação de hidrogenação de eteno, que acontece a quente e na presença de um catalisador em um reator, para responder a questão.
ETENO + H2 → X
A seguinte tabela apresenta informações acerca da energia, em termos de entalpia, de algumas ligações químicas.

Com base nessas informações, a entalpia da reação de hidrogenação de eteno é, em aproximadamente igual a
Uma amostra contendo 514 mg de C8 H18, um dos componentes da gasolina, foi colocada em um calorímetro com oxigênio suficiente para promover a combustão completa. O calorímetro foi preenchido com 1,8 L de água e a capacidade calorífica do interior do calorímetro (sem água) é 1,06 kJ.°C-1. A reação promove uma variação de temperatura de 2,8 °C.
Dados: Capacidade calorífica molar da água = 75,3 J.°C-1.mol-1.
Massas atômicas: C=12; H=1
Qual é o calor de combustão por mol, aproximado, de C8 H18?
O Cloreto de alumínio sólido é um ácido de Lewis muito utilizado nas reações de substituição orgânica.
O valor da entalpia padrão de formação deste ácido de Lewis encontra-se entre:
Dados:
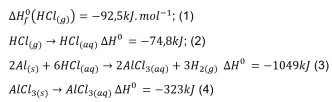
(Fonte: ATKINS, Peter; JONES, Loretta; LAVERMAN,
Leroy. Princípios de Química: Questionando a Vida
Moderna e o Meio Ambiente. Bookman Editora, 2018)
São apresentados na tabela abaixo os valores de entalpia de vaporização e os pontos de ebulição de algumas substâncias:
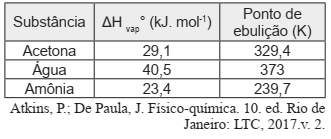
A entropia de vaporização, ΔS vap, da acetona, água e
amônia em J.K-1.mol -1, são, respectivamente: