Questões de Concurso
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 453 questões
As equações químicas seguintes ilustram as mudanças de estado físico da água, realizadas à pressão constante.
H2O (s) → H2O (l) ΔH1
H2O (l) → H2O (g) ΔH2
Considerando as variações de entalpia indicadas, assinale a alternativa correta.
C2H4(g) + 6 F2(g) → 2 CF4(g) + 4 HF(g)
A partir das entalpias de formação (∆Hof) abaixo:
H2(g) + F2(g) → 2 HF(g) ∆Hof = - 537,6 kJ C(s) + 2 F2(g) → CF4(g) ∆Hof = - 680 kJ 2 C(s) + 2 H2(g) → C2H4(g) ∆Hof = + 52,3 kJ
BROWN, T. L.; LEMAY JR., H. E.; BURSTEN, B. E. Química, a Ciência Central. Tradutor Robson Matos, São Paulo: Pearson Prentice Hall, 2005, 5ª impressão em 2010.
Marque a alternativa que corresponde ao valor de variação de entalpia (∆Hor ) da reação do etileno com o gás flúor.
Abaixo está representado o ciclo de Born-Haber para o cloreto de sódio sólido.
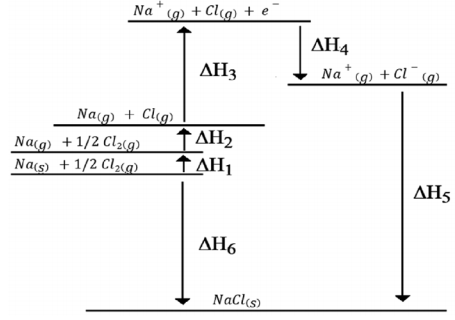
Qual das seguintes alternativas NÃO identifica corretamente a etapa correspondente na ilustração:
dentifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ).
( ) De acordo com o princípio da conservação da energia, a energia não pode ser criada nem destruída, mas somente transformada de uma espécie em outra.
( ) O estado de equilíbrio químico ocorre no momento em que o sistema reacional estaciona e a reação é completada.
( ) Aproximadamente 1,3 kW m-2 da energia radiante solar atinge a Terra, porém somente cerca de 5% desta energia é convertida em carboidratos pela fotossíntese.
( ) Denomina-se “processo exotérmico” aquele que absorve calor e apresenta ∆H > 0.
( ) Aumentar a quantidade dos reagentes é a única maneira de se elevar o valor da constante de equilíbrio de uma reação química.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
Considerando os seguintes dados, calcule o calor de combustão do etino, C2 H2, conhecido comercialmente como acetileno.
2C(grafite) + H2 (g) → C2 H2 (g) ∆Hf0 = +226,73 kJ.mol–1
C(grafite) + O2 (g) → CO2 (g) ∆Hf0 = –393,51 kJ.mol–1
H2 (g) + ½O2 (g) → H2 O(l) ∆Hf0 = –285,83 kJ.mol–1
O calor de combustão do acetileno, (∆Hr0 ), é:

A partir dos dados extraídos do gráfico responda aos itens abaixo:
Admitindo-se que, para uma certa reação, o segmento AB representa o nível da entalpia dos reagentes e o segmento FG o nível da entalpia dos produtos, podemos afirmar que:
1. A reação direta é exotérmica.
2. A energia de ativação desse processo é representada pelo segmento FG. 3. O perfil do gráfico permite afirmar que a reação direta representa uma reação de combustão. 4. A variação de entalpia (energia) de reação direta é de ΔH = – 600,00 kJ. 5. A reação inversa é exotérmica.
Assinale a alternativa que indica todas as afirmativas corretas.
No que se refere à termoquímica, a reações exotérmicas e endotérmicas e à variação de entalpia, julgue o item
Um processo endotérmico ocorre com absorção de calor
(ΔH < 0), como, por exemplo, no processo de
congelamento da água. Um processo exotérmico ocorre
com liberação de calor (ΔH > 0), como, por exemplo, no
processo de vaporização da água.
No que se refere à termoquímica, a reações exotérmicas e endotérmicas e à variação de entalpia, julgue o item
Quando uma reação química se realiza à pressão
constante, a quantidade de calor liberado ou absorvido
é expressa pela variação da entalpia do sistema. Seu
sinal algébrico indica se a reação é endotérmica ou
exotérmica.
No que se refere à termoquímica, a reações exotérmicas e endotérmicas e à variação de entalpia, julgue o item
Grande parte dos processos químicos é conduzida à
pressão constante ou quase constante. Com isso, o calor
absorvido em uma reação é igual à soma do aumento na
energia do sistema com qualquer trabalho realizado
sobre o sistema.
No que se refere à termoquímica, a reações exotérmicas e endotérmicas e à variação de entalpia, julgue o item
A quantidade de calor que é absorvida ou liberada por
um sistema durante uma variação independe de como a
variação ocorre.
No que se refere à termoquímica, a reações exotérmicas e endotérmicas e à variação de entalpia, julgue o item
A termoquímica é o ramo da química sobre a relação
entre calor e transformações químicas. A quantidade de
calor liberado ou absorvido em um sistema reagente
depende da natureza da reação, das quantidades dos
reagentes e das condições impostas na mistura
reagente.
A entalpia de uma reação é a soma das entalpias de qualquer sequência de reações (na mesma temperatura e pressão) na qual a reação total pode ser dividida. Assim, a variação de entalpia para qualquer processo depende somente da natureza dos reagentes e dos produtos e independe do número de etapas do processo ou da maneira como é realizada a reação.
A tabela a seguir lista as reações de combustão do carbono sólido C(s) como grafite, do gás hidrogênio H2(g) e do gás metano CH4(g). As variações de entalpia (ΔH) para essas reações também estão listadas na tabela.
reação ΔH
C(s) + O2(g) → CO2(g) x
H2(g) + ½O2(g) → H2O(l) y
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) z
NH3 (g) + HCl (g) → NH4 Cl (s) ∆H0 = –176 kJ N2 (g) + 3H2 (g) → 2NH3 (g) ∆H0 = –92,2 kJ N2 (g) + 4H2 (g) + Cl2 (g) → 2NH4 Cl (s) ∆H0 = –628,9 kJ
Com base nas equações, é correto afirmar que a entalpia de reação de síntese do gás cloreto de hidrogênio é, em quilojoules, aproximadamente igual a:
NH3 (g) + O2 (g) → NO (g) + H2O (L)
O quadro a seguir apresenta os valores da entalpia-padrão de formação e da entropia molar dos compostos NH3 , NO, O2 e H2O, respectivamente.
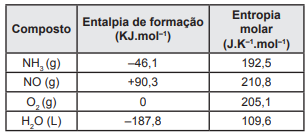 A partir dessas informações, assinale a alternativa
INCORRETA.
A partir dessas informações, assinale a alternativa
INCORRETA.Julgue o item a seguir, relativo à termoquímica e a assuntos correlatos.
A entalpia de uma reação é a soma das entalpias de qualquer sequência de reações (na mesma temperatura e pressão) na qual a reação total pode ser dividida.
Assim, a variação de entalpia para qualquer processo depende somente da natureza dos reagentes e dos produtos e independe do número de etapas do processo
ou da maneira como é realizada a reação.
Julgue o item a seguir, relativo à termoquímica e a assuntos correlatos.
As reações químicas são acompanhadas de liberação ou absorção de energia. Se a energia dos produtos é maior que a dos reagentes, a energia é liberada; se a energia dos produtos é menor que a energia dos reagentes, o sistema absorve a energia das vizinhanças durante o curso da reação. Isso está de acordo com a lei da conservação de energia.
Julgue o item a seguir, relativo à termoquímica e a assuntos correlatos.
A quantidade de calor absorvida por um sistema é um número positivo quando o sistema absorve calor das vizinhanças (processo endotérmico). Quando o fluxo de calor está na direção oposta, o sistema perde calor para
as vizinhanças e a quantidade de calor absorvida pelo sistema é um número negativo (processo exotérmico).

