Questões de Concurso
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 453 questões
Texto para a questão.
A solubilidade é um dos temas mais relevantes da área da química, tanto por sua importância intrínseca quanto pela variedade de fenômenos e propriedades químicas envolvidas em seu entendimento. O processo de solubilização de uma substância resulta da interação entre a espécie que se deseja solubilizar (soluto) e a substância que a dissolve (solvente) e pode ser definida como a quantidade de soluto que dissolve, em uma determinada quantidade de solvente, em condições de equilíbrio. Solubilidade é, portanto, um termo quantitativo.
C. R. Martins, W. A. Lopes e J. B. Andrade. Solubilidade das
substâncias orgânicas. In: Química Nova, v. 36, n.° 8,
2013, p. 1.248-1.255 (com adaptações).
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de água produzido, a energia liberada é de
109 kcal.
Muitas reações envolvem o ganho ou a perda de energia e são chamadas de reações endotérmicas ou exotérmicas. Para o estudo quantitativo desta variação de energia utilizamos ΔH, que é igual à quantidade de calor trocado à pressão constante. Nesse estudo, foram formuladas três leis conhecidas como Leis da Termodinâmica; analise-as.
I. O valor de ΔH é diretamente proporcional à quantidade de reagente ou produto, desde que não haja reagente limitante.
II. O ΔH para uma reação é igual em módulo, mas de sinal contrário ao ΔH da reação inversa, ou seja, a quantidade de calor liberado e a de calor recebido são iguais.
III. O valor de ΔH para uma reação é o mesmo, seja a reação direta ou em etapas.
Corresponde(m) às Leis da Termodinâmica apenas
C3 H8 (g) + 5 O2 (g) → 3 CO2 (g) + 4 H2 O (g); ∆Ho = -490 kJ mol-1
A queima de uma quantidade de propano produziu 98.000 kJ de calor.
Conclui-se que a massa, em gramas, de propano que reagiu foi
Dado M (C3 H8 ) = 44 g mol-1
Ao expressar essa energia em termos de massa de glicose, o atleta deve ingerir, em gramas, aproximadamente,
Dado M(C) = 12 g mol-1 M (O) = 16 g mol-1 M(H) = 1 g mol-1
A reação química representada a seguir corresponde à combustão do etanol a 20 °C:
C2 H6 O (l) + 3 O2 (g) → 2 CO2 (g) + 3 H2 O (g)
Três grandezas termodinâmicas associadas à essa reação são:
ΔH = variação de entalpia
ΔS = variação de entropia
ΔG = variação da energia livre de Gibbs
Analisando-se a reação em relação a essas grandezas, constata-se que
A combustão do etanol produz calor por conta da variação de entalpia (ΔH) de reação, como indicado na equação a seguir:
C2H5OH (ℓ) + 3O2 (g) → 2CO2 (g) + 3H2O (g) ΔH = - 327 kcal
Sabendo-se que a densidade do etanol é 0,80 g mL-1 , e considerando-se combustão completa, pressão constante e um calor liberado de 9810 kJ, o volume, em litros, de etanol que reagiu foi
Dado
M (C2H5OH) = 46 g mol-1
Considere o texto e a figura a seguir para responder à questão.
Um quarto de quilograma de uma amostra de matéria desconhecida, inicialmente no estado sólido a 35°C, é aquecido à taxa de 150 calorias por minuto, e a variação de temperatura foi acompanhada conforme apresentado no gráfico da figura a seguir:

Considere que o combustível empregado num veículo leve seja o etanol puro e que a reação de combustão desse combustível, no motor do veículo, seja completa. A tabela a seguir, apresenta informações acerca da energia, em termos de entalpia das ligações químicas.

ATKINS, P.; JONES, L. Chemical principles, the quest for insight. 6. ed. New York. P.300 (Adaptado).
Com bases nessas informações, a entalpia de combustão do etanol, em kj/mol é
aproximadamente igual a
Considere as reações a seguir a 25°C e 1 atm.

Com base nessas informações e considerando que nas reações 2 e 3 o valor de ΔH é referente à reação balanceada com os menores números inteiros, determine o valor aproximado da entalpia da reação de hidrogenação do acetileno.
Observação: Para o cálculo do valor de ΔH da reação de hidrogenação do acetileno, esta deverá ser balanceada com os menores números inteiros que fazem o seu correto balanceamento.
Considere o texto a seguir para responder à questão.
A reação de ionização do ácido clorídrico, HCl(g) → H+(aq) + Cl-(aq) , processa-se a 25°C e 1 atm e são conhecidos os seguintes valores termodinâmicos ΔH = -75 kj/mol e ΔS = -131, 5 J/(mol. K).
Considere o texto a seguir para responder à questão.
A reação de ionização do ácido clorídrico, HCl(g) → H+(aq) + Cl-(aq) , processa-se a 25°C e 1 atm e são conhecidos os seguintes valores termodinâmicos ΔH = -75 kj/mol e ΔS = -131, 5 J/(mol. K).
Acerca da entropia da reação, analise as asserções a seguir:
O valor negativo de ΔS indica que um mol de H+(aq) mais um mol de Cl-(q) são menos desordenados que um mol de HCl gasoso separado do solvente água.
PORQUE
Os íons aquosos são mais desordenados que compostos no estado gasoso.
Referente às asserções, é correto afirmar que
O hexafluoreto de urânio é uma substância de importância tecnológica, sendo utilizado como matéria prima para obtenção e enriquecimento do urânio metálico. A figura a seguir apresenta o diagrama de fases dessa substância:

IAEA - International Atomic Energy Agency. Disponível em: https://www.iaea.org (Adaptado).
Uma amostra de 704 g de hexafluoreto de urânio, inicialmente a 30°C e 1 atm, foi submetida aos seguintes procedimentos, realizados em sequência, em um laboratório:
1. aquecimento à pressão constante até 100°C;
2. compressão isotérmica (100°C) até 7 atm;
3. resfriamento à pressão constante (7 atm) até 20°C.
Uma reação em fase gasosa se propaga em duas etapas, como indicado pelo diagrama energético a seguir:
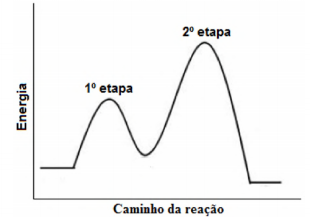
Em relação ao tema, assinale a alternativa
correta.
A cinética química estuda a velocidade com que as reações químicas se processam. Sobre cinética química julgue os itens a seguir.
I . Quanto mais alta a energia de ativação mais lenta será a reação.
II. Quanto menor a concentração dos reagentes, mais lenta será a reação.
III. Reações envolvendo reagentes exclusivamente no estado gasoso têm sua velocida de aumentada quando se diminui a pressão.
Está(ão) correta(s) a(s) sentença(s):
Em 1937 ocorreu o desastre do Hindenburg em Nova Jersey. O dirigível alemão, cheio de hidrogênio gasoso, foi destruído em um incêndio de grandes proporções. São dadas as seguintes proposições sobre o fenômeno.
I. Trata-se de uma reação exotérmica, na qual a energia de ativação é diretamente proporcional a quantidade de matéria presente, onde o total de entalpia liberada é igual ao produto da quantidade de matéria pelo volume total do dirigível.
II. A variação de entropia do sistema em questão (dirigível), ao entrar em combustão, é dado pela quantidade de calor produzida acrescida do trabalho realizado para expansão dos gases durante a explosão.
III. Considerando comportamento do hidrogênio como um gás ideal e a invariabilidade do volume do dirigível, antes da explosão não há realização de trabalho por parte do gás.
São CORRETAS as alternativas:
