Questões de Concurso
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 429 questões
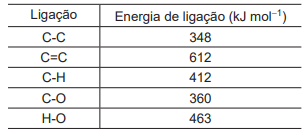
A variação de entalpia, em kJ mol-1 , da reação correspondente a esse processo industrial é
I - C (s) + H2 O (v) → CO (g) + H2 (g) ∆H° = -28.000 cal mol-1 II - CO (g) + H2 O (v) → CO2 (g) + H2 (g) ∆H° = +9.400 cal mol-1 III - C (s) + 2 H2 O (v) → CO2 (g) + 2 H2 (g)
Considerando-se essas informações, a variação de entalpia, em cal mol-1 , da equação termoquímica III é
CaCO3(s) → CaO(s) + CO2(g); ΔH0 = +179 kJ
Considerando-se o comportamento ideal do gás e o rendimento máximo da reação, a energia necessária, em MJ, para produzir 36 m3 de CO2 , medido nas condições normais de temperatura e pressão (CNTP) é, aproximadamente,
Dado R × T = 24,4 atm L mol-1 M = 106
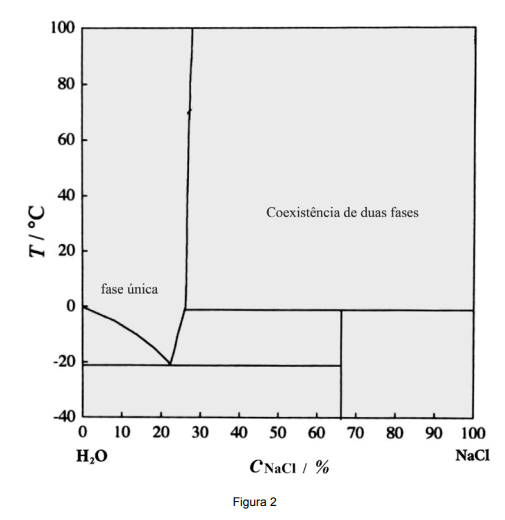
K. Endoh, H. Suga. Thermochimica Acta 327, 1999, p. 134. (Adaptado).
Assinale V (verdadeiro) ou F (falso) diante de cada afirmativa a seguir.
( ) Água com 22% de sal solidifica por volta de -21 ºC.
( ) Em 0 ºC, a água se solidifica para concentrações de sal maiores que 25%.
( ) O gelo flutuando no oceano contém sal de acordo com a linha de liquidus.
( ) A concentração máxima de sal dissolvido em água é de 26% em 20 ºC.
Assinale a alternativa com a sequência correta.
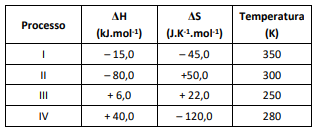
O processo espontâneo é o
Qual o valor mais próximo, em quilojoules, da energia liberada nesse processo?
Cgrafite + O2 (g) → CO2 (g) ∆H = – 393,5 kJ mol–1
Cdiamante + O2 (g) → CO2 (g) ∆H = – 395,4 kJ mol–1
Qual a variação de entalpia necessária, em quilojoules para converter um mol de grafite em diamante?
Com relação às mudanças de estado físico da matéria e à calorimetria, julgue o item subsequente.
Se não existir matéria como meio de propagação, não é
possível a transferência de calor.
Com relação às mudanças de estado físico da matéria e à calorimetria, julgue o item subsequente.
A capacidade térmica de um corpo consiste na quantidade de
calor que ele necessita ceder ou receber para variar sua
temperatura em 1 grau, sendo diretamente proporcional
à sua massa.
Com relação às mudanças de estado físico da matéria e à calorimetria, julgue o item subsequente.
Além dos estados sólido, líquido e gasoso, há o plasma, que
é a condição da matéria associada a partículas muito
energizadas, com certo distanciamento e nenhuma ou pouca
ligação entre si, e cujas propriedades são semelhantes às do
estado líquido, mas com uma energia cinética maior.
Com relação às mudanças de estado físico da matéria e à calorimetria, julgue o item subsequente.
As mudanças de estado de líquido para gasoso podem ser
corretamente chamadas de evaporação, ebulição e calefação,
as quais se diferenciam principalmente pela velocidade em
que ocorrem.
Cr2O72- + 14 H+ + 6 Fe2+ → 2 Cr3+ + 6 Fe3+ + 7 H2O
50,00mL de amostra, livre de interferentes, foi tratada com 25,00mL de solução de K2Cr2O7 com concentração igual a 0,04167mol.L-1 , além de H2SO4 e Ag2SO4. A titulação do excesso de dicromato na amostra consumiu 12,50mL de solução de sulfato ferroso amoniacal 0,2500mol.L-1 . A titulação do branco consumiu 25,00mL de solução de sulfato ferroso amoniacal 0,2500mol.L-1 .
Dado: Massa molar de O2 = 32,00 g.mol-1 .
A DQO da amostra, expressa em mgO2 L-1 , é igual a
C3H8(g) + 5 O2(g) ⇌ 3 CO2(g) + 4 H2O(l) ΔHc° = 2.220 kJ
Tendo as informações precedentes como referência inicial, julgue o próximo item.
A entalpia de formação do propano pode ser obtida pela diferença entre ΔHc° e a soma das entalpias padrão de formação dos produtos da reação de combustão mostrada.
Calcule a variação de entalpia quando 72 g de gelo se fundem.
Considere: ΔH fus= 6009,5 J/mol
H0 = pKa(BH+) - log [BH+] / [B]
onde B é um indicador básico, BH+ é o ácido conjugado desse indicador e pKa(BH+) é a constante de acidez deste último. Quando o indicador é nitroanilina (C6H6N2O2), experimentos realizados para ácidos puros nas mesmas condições, permitem construir a tabela abaixo:
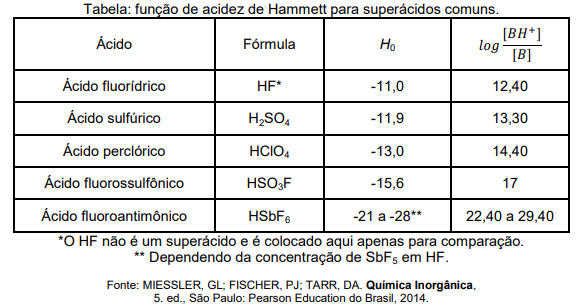
Diante dessas informações, assinale a opção que mostra a ÚNICA reação termodinamicamente espontânea entre pares das substâncias citadas acima:
A variação de entalpia da reação de produção do carbureto de cálcio é igual a
Dados: Massas molares (g.mol-1 ): H=1; C =12; N=14.
A variação de entalpia da reação apresentada, em kJ, é