Questões de Concurso
Comentadas sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 334 questões
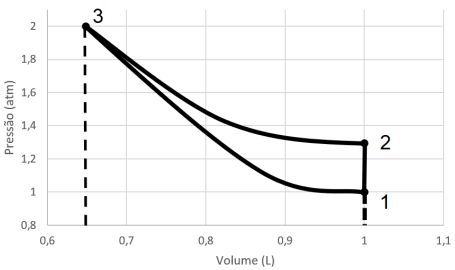
Considerando os aspectos termoquímicos, julgue o item que se segue.
Segundo a Lei de Hess, a avaliação de entalpia de uma
reação independe do estado inicial dos reagentes e do estado
final dos produtos.
Considere os dados termoquímicos:
B2H6(g) + 3 O2(g) → B2O3(s) + 3 H2O(g) ΔHo= -1941 kJ mol–1 2 B(s) + 3/2 O2(g) → B2O3(s) ΔHo= -2368 kJ mol–1 H2(g) + 1/2 O2(g) → H2O(g) ΔHo= -241,8 kJ mol–1
A entalpia padrão de formação do diborano (em kJ mol–1) é
Considere as seguintes equações de reação:
I. N2 (g) + 3Cl2 (g) → 2NCl3 (g) ΔHº > 0
II. N2 F4 (g) → 2NF2 (g) ΔHº > 0
A respeito da espontaneidade dessas reações, é correto afirmar que
Uma reação química, com variação de energia livre de Gibbs negativa, é uma reação
Observe o fenômeno representado pela equação química a seguir.
H2O(l) → H2O(g)
Esse processo pode ser classificado como fenômeno
Qual é o ΔHr para a reação hipotética A + B + D → E, sabendo que
A + B → C _____ ΔH = 1200 kJ
E → C + D _____ ΔH = -600kJ?
CH4(g) + 2O2(g) → CO2(g) + 2 H2O(l)
Dados:
Calores de Formação:
• H2O (l): ΔHf = - 68 kcal/mol • CO2 (g): ΔHf = - 94 kcal/mol • CH4(g): ΔHf = - 18 kcal/mol
De acordo com os dados dos calores de formação acima, assinale a alternativa que apresenta a entalpia (ΔH) da reação.
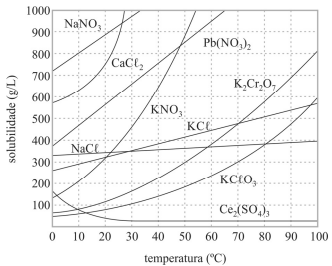
As dissoluções dos sais apresentados no gráfico são processos endotérmicos.
Observe atentamente as equações químicas a seguir:
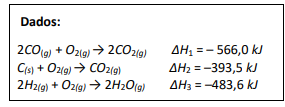
Equação global: C(s) + H2O(g) → CO(g) + H2(g) ΔH4 =_____ kJ
Considerando os conceitos termoquímicos e os dados fornecidos, assinale a afirmativa correta.
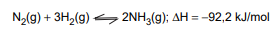
Como a reação é
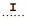 , a diminuição da temperatura provoca um deslocamento de equilíbrio para o sentido
, a diminuição da temperatura provoca um deslocamento de equilíbrio para o sentido 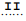 . O aumento de
pressão provoca contração de volume, o que desloca o equilíbrio para o sentido
. O aumento de
pressão provoca contração de volume, o que desloca o equilíbrio para o sentido  , ou seja, para o lado de
, ou seja, para o lado de 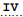 volume.
Completam as lacunas, correta e respectivamente,
volume.
Completam as lacunas, correta e respectivamente, Atenção: a Tabela abaixo deve ser usada como apoio para responder a questão de Química.
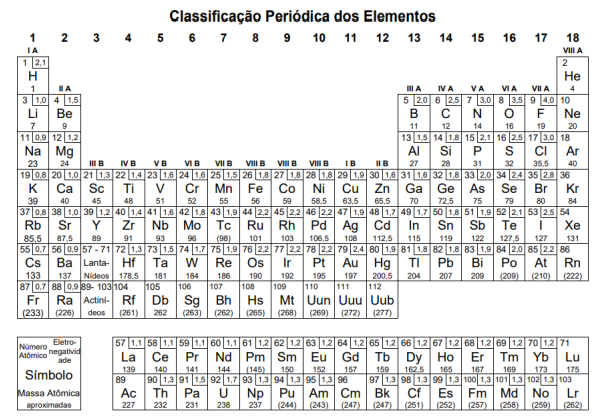
A tabela a seguir contém algumas dessas substâncias e suas respectivas entalpias de combustão (ΔHc0):
Substância Fórmula ΔHc 0 (kJ.mol-1 )
Metano CH4 –890
Butano C4H10 –2878
Octano C8H18 –5471
Metanol CH3OH –726
Etanol C2H5OH –1368
A substância que libera a maior quantidade de energia por grama de combustível é o
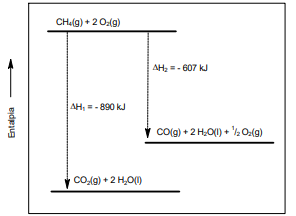
A partir dos dados apresentados, analise as afirmações:
I. Os valores de ΔH1 e ΔH2 indicam processos exotérmicos.
II. A energia envolvida na combustão parcial de 1 mol de metano é 890 kJ.
III. A combustão de 5 mols de monóxido de carbono (CO) libera 1415 kJ.
Está correto apenas o que se afirma em

Considerando essas informações e os diversos aspectos a elas relacionados, julgue o item.
Conclui-se que a conversão da hematita para Fe(s) é
favorecida em temperaturas abaixo de 623 K.

Essa reação ocorreu a partir de 0,07 m3 de uma mistura gasosa que possui 70% em massa de amônia e cuja densidade é 0,9 g/L. A eficiência do processo foi de 65% e foram observadas as seguintes reações químicas e respectivas variações de entalpia (∆Hn, em que n = 1 ou 2):

Nessa situação hipotética, considerando-se que
 sejam as massas molares
da hidrazina e da amônia, respectivamente, a variação de entalpia
envolvida na quebra da amônia, caso o rendimento da reação
tivesse sido de 100%, seria
sejam as massas molares
da hidrazina e da amônia, respectivamente, a variação de entalpia
envolvida na quebra da amônia, caso o rendimento da reação
tivesse sido de 100%, seria 
Caso essa reação seja realizada em etapas, as reações de cada etapa serão as seguintes, em que ∆Hn (n = 1, 2 ou 3) representa a variação de entalpia da n-ésima etapa:

A partir da Lei de Hess, é possível calcular a variação de entalpia envolvida na primeira reação.
Nessa situação, considerando-se que MFe = 56 g/mol seja a massa molar do ferro, é correto concluir que a variação de entalpia envolvida na formação de 140 g de ferro metálico por meio da redução do óxido ferroso pelo monóxido de carbono é
