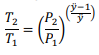Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.539 questões
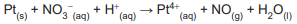
A soma dos coeficientes estequiométricos de reagentes e produtos na reação balanceada é
Dados: MMCu = 63,5 g mol-1 / Constante de Faraday = 96500 C
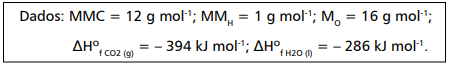
Considerando essas informações, o calor de formação estimado para a glicose, em kJ mol-1, é
Nessas condições, o valor da energia livre de Gibbs padrão da reação, em kJ mol-1, é mais próximo de
Dado
Constante de Faraday (F) = 96500 C mol-1
Nessas condições, a diferença de potencial (
 E) medida,
em volts, é
E) medida,
em volts, é Dado
Potências de redução versus eletrodo padrão de hidrogênio:
Fe3+(aq) + e → Fe2+(aq) Eo = +0,77 V
Sn4+(aq) + 2e → Sn2+(aq) Eo = +0,15 V
Equação de Nernst:
E = Eo redução – 0,06 log([produtos]n/[reagentes]m)
O radionuclídeo 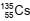 decai através da emissão de radiação Beta (β-
), transformando-se em
decai através da emissão de radiação Beta (β-
), transformando-se em 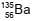 .
Qual é a energia de desintegração para esse decaimento, em unidades de MeV, considerando-se as massas de
134,905977u e 134,905688u para
.
Qual é a energia de desintegração para esse decaimento, em unidades de MeV, considerando-se as massas de
134,905977u e 134,905688u para 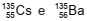 , respectivamente?
, respectivamente?
Dado
u.c2 = 931,5 MeV
De acordo com as Diretrizes Básicas de Proteção Radiológica da CNEN, a dose que pode ser absorvida pelo corpo humano de um indivíduo ocupacionalmente exposto é de 20 mSv.
Considerando-se um indivíduo com fator de efetividade biológica relativa igual a 5, e massa igual a 85 kg, a dose máxima de radiação que pode ser absorvida por esse indivíduo, em Gy, é de
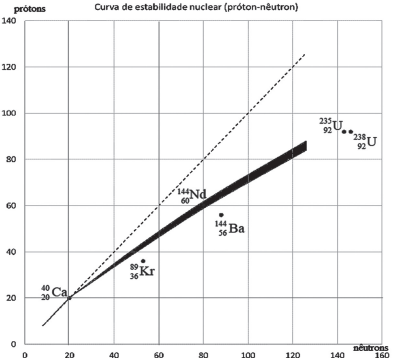
Considerando-se a Figura, verifica-se que o(a)
Em um equipamento de proteção radiológica, uma peça de 0,7 kg de chumbo tem sua temperatura elevada de 30ºC para 70ºC ao receber uma determinada quantidade de calor.
Sendo o calor específico do chumbo igual a 130 J kg-1
K-1
,
a quantidade de calor, em joules, recebida pela peça é
igual a
NO-3 + 8 Cℓ- + 10H+ → 4 Cℓ2 + NH+4 + 3 H2O
Nessa reação, a espécie química que sofre oxidação é
Na reação nuclear entre 1 átomo de rádio-226 e 1 átomo de cálcio-48, são formados 1 átomo de um determinado radioisótopo e 4 nêutrons.
O radioisótopo formado na reação é o
O radioisótopo 209Bi decai com a emissão de uma partícula nuclear e formação de 205Tl.
A partícula nuclear emitida nesse decaimento corresponde a
Uma amostra de cúrio-242 decaiu de 40 mg para 10 mg em 324 dias.
O tempo de meia-vida, em dias, do cúrio-242 é
H2SO4 + Ba(OH)2 → BaSO4 + 2 H2O
As entalpias-padrão de formação ( ΔH0form ) dos participantes da reação são apresentadas a seguir.
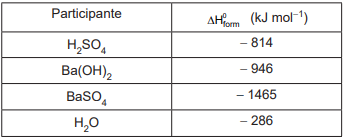
A variação de entalpia-padrão dessa reação, em kJ mol-1 , corresponde a
No que se refere aos fundamentos dos métodos espectroscópicos de análise, julgue o próximo item.
Existem duas limitações instrumentais importantes para a
Lei de Beer-Lambert: essa lei é estritamente válida para
radiações monocromáticas puras, o que é muito difícil de
conseguir; e radiações de fundo, originadas por imperfeições
no seletor de comprimento de onda, podem atingir o
detector. Essas limitações são as principais causas dos
desvios da Lei de Beer-Lambert.
Acerca do equilíbrio em células galvânicas, julgue o próximo item.
Considera-se que o potencial produzido por uma célula
galvânica seja a soma das contribuições do anodo e do
catodo, ainda que o potencial de junção líquida seja
considerável.
Acerca do equilíbrio em células galvânicas, julgue o próximo item.
A equação de Gibbs, ΔG = ΔGº + RT lnQ, traduz a
dependência da tensão imposta a células eletroquímicas em
relação às concentrações das espécies envolvidas.
Acerca do equilíbrio em células galvânicas, julgue o próximo item.
O potencial arbitrariamente atribuído ao eletrodo-padrão de
hidrogênio, na faixa de temperatura de 20 ℃ até 30 ℃, é
0 V.
No que se refere à entropia e ao terceiro princípio da termodinâmica, julgue o item seguinte.
Considere um gás ideal com capacidade calorífica constante de ÿ passando por um processo reversível adiabático. Nesse caso, a razão entre as temperaturas inicial e final, T1 e T2, e as pressões inicial e final, P1 e P2, desse sistema pode ser corretamente escrita pela seguinte fórmula.