Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.539 questões
No experimento descrito a seguir sobre física térmica, o objetivo é avaliar que tal como os líquidos, os gases também sofrem expansão e contração.
Dessa forma, complete corretamente a frase a seguir:
Num recipiente de 500 mL de água quente e em outro a mesma quantidade de água fria, limpe a garrafa e deixe-a secar. No procedimento, pegar uma bexiga e envolver no gargalo da garrafa. Em seguida, colocar a garrafa dentro do recipiente com água quente. Observar que a bexiga após aproximadamente 25 segundos estará _______________. Em seguida, colocar a garrafa dentro do recipiente com água fria e verificar que a bexiga irá _______________.
Após análise, assinale a alternativa CORRETA que complete a frase citada acima:
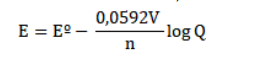
Zn+2(aq)/Zn(s)= - 0,763 V NO3 - /NO(g) = 0,96 V P NO(g) = 2,0 atm [H+ ] = 1,0 mol/L [Zn+2] = 1,0 mol/L [NO3 - ]= 1,0 mol/L
têm-se:
Observe a imagem.
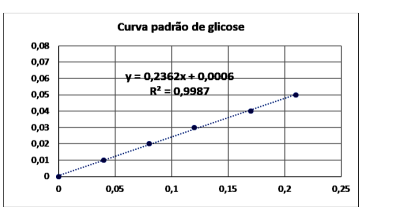
Dentre esses valores de absorbância obtidos, o que pode ser relacionado a concentração de 0,23 mg/mL é
Observe o diagrama de energia a seguir.
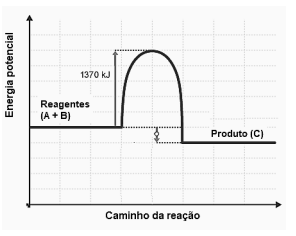
O diagrama se refere a uma reação do tipo
As termobalanças são instrumentos que permitem a pesagem contínua de uma amostra em função da temperatura, ou seja, a medida em que ela é aquecida ou resfriada.
As curvas de variação de massa (em geral perda, mais raramente ganho de massa) em função da temperatura permitem tirar conclusões sobre a estabilidade térmica da amostra, sobre a composição e estabilidade dos compostos intermediários e sobre a composição de resíduo.
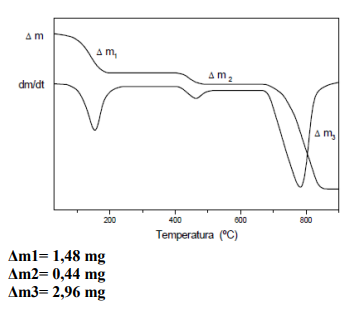
Sabendo que a curva de variação de massa acima é de uma amostra de CaMg(CO3)2 ou Ca(CO3) + Mg(CO3) de massa 10 mg, tendo a primeira perda de massa da amostra referente a águas de hidratação, que posteriormente ocorrem a formação dos resíduos óxido de magnésio e óxido de cálcio separadamente e respectivamente. Qual o percentual de óxido de magnésio formado?
I. A equação
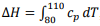 , pode ser usada para
calcular a variação da entalpia associado ao
aquecimento de um mol da substância. II. Se a substância for um líquido ou sólido, o
processo de aquecimento terá praticamente o
mesmo gasto energético a volume constante e
a pressão constante.
III. Se a substância for um gás ideal, o processo de
aquecimento a pressão constante gastará mais
energia que o processo de aquecimento a
volume constante.
, pode ser usada para
calcular a variação da entalpia associado ao
aquecimento de um mol da substância. II. Se a substância for um líquido ou sólido, o
processo de aquecimento terá praticamente o
mesmo gasto energético a volume constante e
a pressão constante.
III. Se a substância for um gás ideal, o processo de
aquecimento a pressão constante gastará mais
energia que o processo de aquecimento a
volume constante. Assinale a alternativa que contém a análise correta.
I - Realizarem-se, necessariamente, na presença de água líquida.
II - Realizarem-se em temperaturas, acima do ponto de orvalho.
III - Realizarem-se devido à formação de pilhas de corrosão ou células eletroquímicas.
Está correto o que se afirma em:
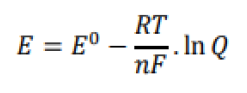
Considerando a equação, acima, E0 representa:
Assinale a alternativa que preenche, corretamente, a lacuna do texto:
I - Reação espontânea.
II - Dividida em Ígnea e Aquosa.
III - Precisa de energia elétrica para ocorrer.
Está correto o que se afirma em:
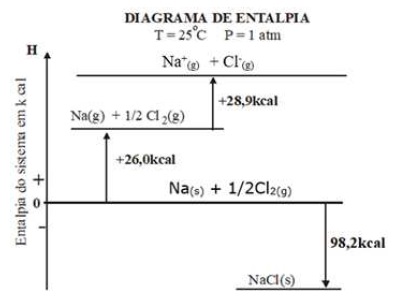
1 C4H10(g) + 6.5 O2(g) → 4 CO2(g) + 5 H2O(g)
Analisando a equação acima balanceada adequadamente e os dados de entalpiaspadrão de formação de cada um dos seus componentes (abaixo), assinale a alternativa que apresenta qual será o valor de ∆H (calor de reação), em Kcal, para a queima completa do butano Dados: entalpias-padrão de formação para 1mol da substância: 4 C(s) + 5 H2(g) → 1C4H10(g) ∆H = -125 Kcal; 1 C(s) + 1O2(g) → 1CO2(g) ∆H = -394 Kcal e 1 H2(g) + 0.5 O2(g) → 1 H2O(g) ∆H = -242 Kcal
A2 + B2 → 2 AB
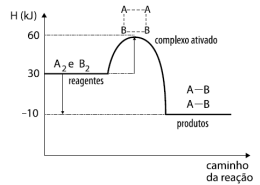
Disponível em: i_662d64349cafcb5b_html_55011cd1.png (463×350) (quimicaevestibular.com.br). Acesso em 27 de Julho de 2021.
Com relação ao gráfico acima, temos as seguintes afirmativas: I. A reação absorve calor; II. A energia de ativação da reação é 60 KJ; III. O valor da entalpia da reação (∆H) é de -40 KJ; IV. Ao colocarmos um catalisador na reação, diminuímos a sua entalpia (∆H), tornando-a mais rápida.
Estão corretas as afirmativas:
Adaptado. CÉLULA A COMBUSTÍVEL, COMO FUNCIONA – Autoentusiastas. Acesso em 20 de Julho de 2021.
A seguir, temos um esquema da célula a combustível de gás hidrogênio.
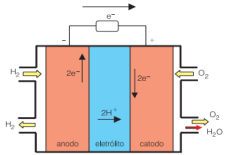
Esquema da célula a combustível de gás hidrogênio. Disponível em: www.usp.br/portalbiossistemas/?p=4316#:~:text=Em outras palavras%2C nessa célula a combustível a,célula a combustível é%3A H2 %2B ½O2→ H2O. Acesso em 20 de Julho de 2021.
A reação global balanceada da célula a combustível de gás hidrogênio é:
H2 (g) + ½O2 (g) → H2O (g)
Analisando o esquema da célula a combustível de gás hidrogênio (acima) e sua reação global balanceada, assinale a alternativa correta.
Adaptado. Pilhas e Baterias de Lítio. Pilha e Baterias de íon lítio (uol.com.br). (Acesso em 23 de Julho de 2021).
Com relação à pilha de lítio usada em marca-passos e as transformações nela ocorridas, assinale a alternativa correta.
- O ar expelido pelos pulmões do suspeito é bombeado em uma solução de dicromato de potássio fortemente acidulada (ácido sulfúrico); - O etanol presente na boca do motorista (se este consumiu bebida alcoólica) reage com os íons dicromato da solução, produzindo acetaldeído e íons Cromo (III); - Em razão da reação química, ocorre uma mudança na cor da solução, a cor característica laranja passa para um tom esverdeado, acusando a presença de álcool etílico ou etanol.
Adaptado. Composição química do Bafômetro - Mundo Educação (uol.com.br). (Acesso em 23 de Julho de 2021)
A reação que ocorre no bafômetro com dicromato de potássio está representada pela equação química não balanceada a seguir:
K2Cr2O7(aq) + x H2SO4(aq) + 3CH3CH2OH(g) → alaranjado incolor
Cr2(SO4)3(aq) + y H2O(l) + 3CH3CHO(g) + K2SO4(aq) verde incolor
Assinale a alternativa que relaciona a classificação e os respectivos valores de x e y (mínimos coeficientes inteiros) que balanceiam corretamente a reação do bafômetro com dicromato de potássio.
A pilha de lítio, muito leve por conta da baixa densidade desse metal, foi utilizada inicialmente apenas em marca-passos cardíacos. As semirreações que ocorrem numa pilha de lítio podem ser descritas por:
A diferença de potencial gerada por essa pilha, em volts, é igual a: