Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.539 questões
CaCO3 (S) → CaO (S) + CO2 (g) ΔH° = 180 kJ/mol
O calor consumido na decomposição de 500 g de CaCO3 é igual a:
Dado: massa molar do CaCO3 = 100 g/mol
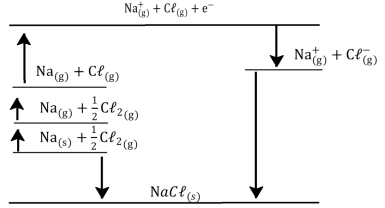
energia de ionização do Na = + 496 kJ.mol – 1 afinidade eletrônica do Cℓ = + 349 kJ.mol – 1 entalpia de atomização Na = + 107 kJ.mol – 1 entalpia de atomização Cℓ = + 122 kJ.mol entalpia padrão de formação do NaCℓ = – 411 kJ.mol – 1
A entalpia de rede do cloreto de sódio é:
A partir da 2ª Lei da Termodinâmica o conceito
de entropia foi criado, a fim de explicar a direção de
um processo ou transformação. Sendo assim, a
entropia total é uma medida de desordem que:
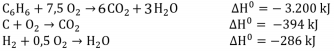
Conclui-se que o ΔH de formação do benzeno é:
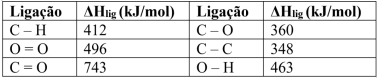
Sabendo que o etanol é vaporizado (ΔHvap = 43,5 kJ/mol) no motor de combustão antes da sua reação com o oxigênio, a entalpia de combustão do etanol líquido é:

A pilha que apresenta maior diferença de potencial padrão pode ser representada esquematicamente por:
Pode-se afirmar que na combustão de 52 g de ácido acético, há: (Dados em g/mol: C = 12, H = 1, O = 16)
Ao efetuar o balanceamento da reação acima, a soma dos menores coeficientes inteiros da reação será:
A temperatura da água aumenta com a dissolução de NaCl.
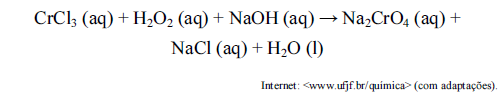
A respeito da reação de oxirredução não balanceada citada no texto acima, assinale a opção correta.
Uma das evidências de que os átomos são formados por partículas menores se veio através de experimentação. Sabemos hoje, que o átomo é formado por elétrons, prótons, e outras partículas subatômicas. Sobre a descoberta do elétron, responda a alternativa correta.
Lei de Hess baseia-se em que uma reação é a soma de outras duas ou mais reações, o 𝛥𝐻 para o processo global é a soma dos valores de 𝛥𝐻daquelas reações.
Calcule o 𝛥𝐻da reação abaixo
½ N2(g) + ½ O2(g) → NO(g)
Use as equações.
I - N2(g) + 3H2(g) →2NH3(g) , 𝛥𝐻° = -91,8Kj
II - 4 NH3(g) + 5 O2(g) →4NO(g) + 6H2O(g) , 𝛥𝐻 ° = - 906,2kJ
III - H2(g) + ½ O2(g)→H2O(g) , 𝛥𝐻° = - 241,8kJ
Observe as reações:
I - H2(g)+ ½O2(g) →H2O(l) , ∆H = -68,3 Kcal/mol
II - C6H4(OH)2(aq) → C6H4O2(aq) + H2(g) - 177kcal
III - C(grafite)+ O2(g) - 94,0kcal → CO2(g)
IV - HgO(s) + 90 kJ → Hg(ℓ) + ½ O2(g)
V - Na(s) + H2O(ℓ) → NaOH + 1/2 H2(g) + 282 kJ
Qual das opções abaixo contém somente reações exotérmicas?
A falta de gás oxigênio em reações de combustão pode levar a uma reação incompleta. Veja os exemplos de reações de combustão completa e incompleta do carvão:
- Combustão completa:
- Combustão incompleta:
Responda a alternativa correta.
As reações nucleares diferem das reações químicas em algumas características peculiares, e isótopos diferentes de um mesmo elemento sofrem essencialmente as mesmas reações químicas, mas seus núcleos sofrem reações nucleares muito diferentes. Quando as partículas α e β são emitidas pelo núcleo, forma-se um núcleo com número diferentes de prótons. Assim, é correto afirmar que:
A análise titrimétrica desempenha um papel importante na análise quantitativa. Os diferentes métodos titrimétricos são classificados em função das reações que ocorrem durante a titulação. O permanganato de potássio, o ácido etilenodiaminotetracético e o cloreto de prata são comumente empregados, respectivamente, nas análises titrimétricas denominadas reações de:
Um analista utilizou para a determinação de Fe3+ uma solução de Mg-EDTA. Em uma primeira etapa, ocorre a seguinte reação:
Fe3+ + MgY2- → FeY- + Mg2+
Posteriormente, os íons Mg2+ são titulados com solução padrão de EDTA. Assinale a opção que apresenta o nome correto do procedimento adotado para essa titulação com EDTA.
Considere a pilha galvânica Cd(s)|Cd(NO3)2(aq)||AgNO3(aq)|Ag(s).
Os potenciais-padrão de redução, de cada meia-célula, em relação ao Eletrodo Padrão de Hidrogênio são dados abaixo:
Cd2+(aq) + 2e- → Cd(s) Eº = -0,402 V
Ag+(aq) + e- → Ag(s) Eº = +0,799 V
Sabe-se que o potencial padrão de redução do eletrodo de calomelano em relação ao eletrodo padrão de hidrogênio é +0,268 V.
Assim, assinale a opção que apresenta o potencial de redução do cátodo da pilha supracitada em relação ao eletrodo de calomelano, em Volts.