Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.539 questões
Na reação 2 MnO4 - + 3 H2O2 + 2H+ → 2 MnO2 + 3 O2 + 4 H2O, o agente redutor e o NOX do elemento químico que sofre redução, são, respectivamente:
No laboratório, há uma solução de peróxido de hidrogênio 35,0% (v/v) em água.
Sabendo-se que, nas práticas de titulação de oxirredução, utiliza-se uma solução de
peróxido de hidrogênio 8,4% (v/v) em água, qual é o volume de solução de peróxido de
hidrogênio 35,0% (v/v) necessário para preparar 250 mL de solução de peróxido de
hidrogênio 8,4% (v/v)?
A figura seguinte representa o processo de eletrólise empregado na purificação de cobre, no qual por uma solução de sulfato de cobre (CuSO4) passa uma corrente elétrica que promove uma deposição de 8,50 g de cobre no cátodo.
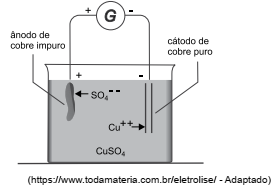
Dados: massas molares Cu=64g; O=16g; S=32g.
Nesse experimento, com base na massa de deposição
de Cobre no cátodo, a massa, em gramas, de sulfato de
cobre (CuSO4) decomposta foi de
A respeito da energia livre de Gibbs, quando um processo ocorreu à pressão e temperatura constantes, um químico fez as seguintes ponderações:
I. Se a variação da energia livre de Gibbs for negativa, a reação química será espontânea num sentido direto da equação química. II. Se a variação da energia livre de Gibbs for nula, a reação química será não espontânea num sentido direto da equação química. III. Se a variação da energia livre de Gibbs for positiva, a reação inversa será espontânea.
Estão corretas as ponderações
Zn (s) → Zn2+ (aq) + 2e- Eº = +0,76 V
Inicialmente, na semicélula 1, a concentração da solução de íons zinco era igual a 1,5 mol/L e, na semicélula 2, a concentração de íon zinco era igual a 0,5 mol/L.
Dado: log3 = 0,5
Com base nessas informações, assinale com V as afirmativas verdadeiras e com F as falsas.
( ) No eletrodo da semicélula 2, encontra-se o catodo da pilha. ( ) No eletrodo da semicélula 1, encontra-se o polo negativo. ( ) A força eletromotriz da pilha é aproximadamente 0,75 V. ( ) Possivelmente, a pilha não funcionará, porque os eletrodos são um único elemento.
Assinale a sequência correta.
I. Tempo de meia-vida biológico
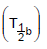 II. Tempo de meia-vida efetivo
II. Tempo de meia-vida efetivo 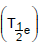 III. Tempo de meia-vida físico ou da partícula
III. Tempo de meia-vida físico ou da partícula 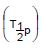
A figura abaixo ilustra o decaimento do estrôncio 85, após ter sido injetado em uma pessoa.
Decaimento do radionuclídeo em um paciente
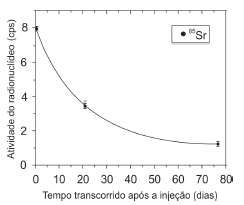
(Adaptado de: Haquin et al., 2004. Biological Half-Life Measurements of Radioactive Strontium in Hormonal-Resistant Prostate Cancer Patients)
Sabendo que o tempo de meia-vida efetivo representa o tempo necessário para um radionuclídeo (contido em um sistema biológico) reduzir a sua atividade pela metade, um resultado combinado entre o decaimento radioativo e a meia‐vida biológica é expresso por:
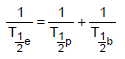
Sabendo que o tempo de meia-vida do Sr-85 vale 1.440 horas, o tempo de meia-vida efetivo aproximado deste radionuclídeo, no interior do paciente que se encontra em tratamento radioterápico é, aproximadamente, igual a
Ela suspeitou que havia se contaminado com um isótopo radioativo do césio. Preocupada, procurou auxílio técnico especializado que constatou que as queimaduras não foram provocadas por radiação ionizante.
Como atualmente esses aparelhos não possuem elementos radioativos, a radiação é do tipo
Ca(OH)2 + HCI → CaCl2 + H2O
Com base nessa reação química, é correto afirmar que
Isótopos radioativos de oxigênio foram utilizados em dois experimentos. No primeiro, foram utilizados para marcar moléculas de dióxido de carbono, enquanto no segundo, esses isótopos foram utilizados para marcar moléculas de água. Em ambos os experimentos, as moléculas marcadas com o isótopo radioativo foram fornecidas a plantas para a realização da fotossíntese.
Após a utilização das moléculas marcadas, pode-se afirmar que os seguintes resultados foram obtidos:
Quando, no estado gasoso, um átomo neutro de cloro absorve energia e perde um elétron, ocorre a formação de íon Cl+(g) de acordo com a equação abaixo:

A energia absorvida é definida como:
A potenciometria se baseia na medida do potencial de células eletroquímicas, sem o consumo apreciável de corrente.
Aponte, entre os termos abaixo, o único que não está relacionado ao estudo dos métodos potenciométricos.
A hidrazina se decompõe em gás nitrogênio e gás hidrogênio, segundo a equação abaixo.
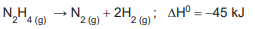
Em relação à sua vizinhança, ao decompor e formar produtos, esse sistema reacional
A decomposição da água é representada na reação termoquímica abaixo.
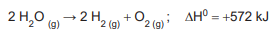
A variação de entalpia, em kJ, de formação de 1 mol de
H2
O(g) será de