Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.539 questões
A decomposição por aquecimento de certa mistura contendo CaCO3, NaHCO3 e material inerte não volátil produz gases e 640g de resíduo seco. Sabendo-se que a quantidade de calor absorvida na decomposição é 298 kcal, a percentagem de material inerte presente na mistura inicial é de:
Dados:
-Na=23 // Ca=40.
-Calores de decomposição do:
a) CaCO3 = 44,0 kcal.
b) NaHCO3 = 15,5 kcal com formação de H2O(g).
Em relação à análise de nitrato dissolvido em água, que se fundamenta na dosagem do íon nitrito obtido por redução quantitativa dos íons nitratos presentes na amostra, considere as seguintes afirmativas:
I. A transformação do íon NO3- em NO2- envolve uma reação de oxidação, em que são envolvidos três elétrons, e assim o N passa da valência 5+ para 2+ .
II. A redução do NO3- é efetuada mediante a passagem da amostra por uma coluna redutora preenchida com grãos de cádmio tratados com solução cúprica.
III. A reação de redução independe do metal usado no redutor do pH da solução e da atividade da superfície do metal.
IV. O cádmio presente na coluna gradativamente consumido durante a passagem da amostra pode perder sua eficiência de redução durante grandes pausas de utilização da coluna redutora.
V. Uma solução de NH4Cℓ é utilizada como tamponante, complexante e ativadora do sistema redox, na coluna redutora.
Assinale a alternativa que apresenta as afirmativas corretas.
A descarga de água subterrânea (Submarine Groundwater Discharge – SGD) tem sido considerada um importante elo entre o continente e o oceano, pois, além de carrear uma parcela considerável de água doce, a SGD é uma importante fonte de elementos para a zona costeira. Traçadores geoquímicos naturais, como o rádio (Ra), tem sido considerados uma excelente ferramenta para estudos que envolvam esse processo, pois, além das águas subterrâneas serem enriquecidas por esse elemento, este apresenta comportamento conservativo e suas constantes de decaimento permitem relações que possibilitam a estimativa dos fluxos subterrâneos. Os isótopos do rádio (223Ra, 224Ra, 226Ra e 228Ra) possuem tempos de meia-vida, respectivamente, iguais a:
Dados: Constantes de decaimento 223Ra= 0,06 dias-1; 224Ra= 0,19 dias-1; 226Ra= 0,43 10-3 anos-1 e 228Ra= 0,12 anos-1 .
Fórmula: λ = 0,693 / t½
Em que:
λ = Constante de decaimento
t½ = Tempo de meia-vida
Considere a reação abaixo e as afirmativas sobre ela, a seguir.
KMnO4 + H2SO4 + H2O2 → K2SO4 + MnSO4 + H2O + O2
I. A sequência correta dos coeficientes estequiométricos de cada uma das substâncias, na ordem em que elas aparecem na reação acima, é 2; 3; 5; 1; 2; 8; 5.
II. O KMnO4 se oxida e o H2O2 se reduz.
III. O KMnO4 ganha 5 elétrons e a H2O2 perde 2 elétrons.
IV. O KMnO4 é o agente oxidante e a H2O2 é o agente redutor.
V. A soma da carga dos reagentes é diferente da soma das cargas dos produtos.
Assinale a alternativa que apresenta a(s) afirmativa(s) correta(s).
Considere a seguinte reação de hidrogenação de eteno, que acontece a quente e na presença de um catalisador em um reator, para responder a questão.
ETENO + H2 → X
A seguinte tabela apresenta informações acerca da energia, em termos de entalpia, de algumas ligações químicas.

Com base nessas informações, a entalpia da reação de hidrogenação de eteno é, em aproximadamente igual a
Pilhas alcalinas geram corrente elétrica por um período de tempo até 50% mais longo do que uma pilha seca do mesmo tamanho. Considere a reação abaixo, que ocorre nas pilhas alcalinas, e indique a alternativa que apresenta corretamente a reação que ocorre no catodo e no anodo.
Zn(s) + 2 MnO2
(s) → ZnO(s) + Mn2
O3
(s)
Uma amostra contendo 514 mg de C8 H18, um dos componentes da gasolina, foi colocada em um calorímetro com oxigênio suficiente para promover a combustão completa. O calorímetro foi preenchido com 1,8 L de água e a capacidade calorífica do interior do calorímetro (sem água) é 1,06 kJ.°C-1. A reação promove uma variação de temperatura de 2,8 °C.
Dados: Capacidade calorífica molar da água = 75,3 J.°C-1.mol-1.
Massas atômicas: C=12; H=1
Qual é o calor de combustão por mol, aproximado, de C8 H18?
O Cloreto de alumínio sólido é um ácido de Lewis muito utilizado nas reações de substituição orgânica.
O valor da entalpia padrão de formação deste ácido de Lewis encontra-se entre:
Dados:
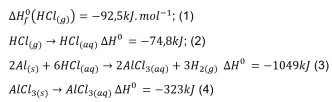
(Fonte: ATKINS, Peter; JONES, Loretta; LAVERMAN,
Leroy. Princípios de Química: Questionando a Vida
Moderna e o Meio Ambiente. Bookman Editora, 2018)
São apresentados na tabela abaixo os valores de entalpia de vaporização e os pontos de ebulição de algumas substâncias:
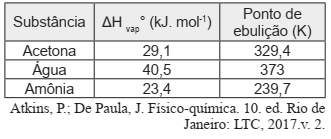
A entropia de vaporização, ΔS vap, da acetona, água e
amônia em J.K-1.mol -1, são, respectivamente:
Considere os potenciais padrões de redução apresentados abaixo:
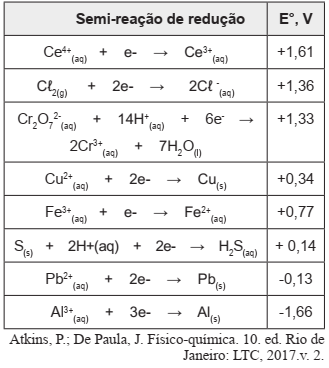
Identifique nas reações abaixo, a que é classificada
como um processo espontâneo.
Em um experimento de laboratório, uma aluna foi solicitada a ordenar 3 elementos (A, B, C) de acordo com seus potenciais de redução. Para isso, realizou o seguinte procedimento: adicionou um pedaço de metal (A, B, C) em soluções aquosas contendo os cátions dos outros metais (A+, B2+, C2+) e também em solução ácida e observou onde ocorreu reação. Ao fim do experimento, elaborou uma tabela onde indicou com X os sistemas onde ocorreram reação com deposição de metal ou desprendimento de H2 , tendo obtido a seguinte tabela:
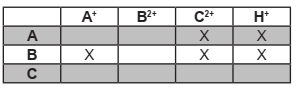
Ao organizar as espécies iônicas por ordem crescente de potencial de redução, com base no procedimento adotado e nos resultados tabelados, têm-se:
Corrosão eletroquímica de um metal é um processo que envolve reações redox espontâneas, como exemplo, a indesejada ferrugem. Esta é originada do processo corrosivo do ferro. Um procedimento para evitar a corrosão é a adição de um metal de sacrifício para ser ______________ preferencialmente por apresentar um ___________ potencial de ____________.
Assinale a alternativa que completa o texto acima corretamente.
A eletroquímica é um ramo da química aplicado em diversos processos tecnológicos. Uma pilha galvânica, por exemplo, é um conjunto de células eletroquímicas usado para a produção de eletricidade. Nesse contexto, assinale a alternativa que apresenta a descrição correta de um dos componentes das pilhas de corrosão eletroquímicas.
As equações químicas seguintes ilustram as mudanças de estado físico da água, realizadas à pressão constante.
H2O (s) → H2O (l) ΔH1
H2O (l) → H2O (g) ΔH2
Considerando as variações de entalpia indicadas, assinale a alternativa correta.
As pilhas ou células galvânicas convertem energia química em elétrica, por meio do aproveitamento do fluxo de elétrons de uma reação de oxirredução. A partir dos potenciais padrão de eletrodo apresentados a seguir, é CORRETO afirmar:
Cu+ + e- → Cu |
E° = + 0,52 V |
Ag+ + e- → Ag |
E° = + 0,80 V |
Co2+ + 2e- → Co |
E° = - 0,28 V |
Zn2+ + 2e- → Zn |
E° = - 0,76 V |
A radioterapia é um método capaz de destruir células tumorais por meio da aplicação de radiação ionizante oriunda de um radioisótopo, como o Co60 , cujo tempo de meia-vida é de 5,3 anos.
Se um equipamento de radioterapia hospitalar contiver 1 kg de Co60, quanto tempo levará para ter sua massa radioativa reduzida a 12,5% do seu valor inicial?
O Urânio 235 sofre fissão por meio da reação representada a seguir:
92U235 + 0n 1 → 56B142 + ZX A + 2 0n1
Indique a alternativa que apresenta os corretos valores do número atômico (Z) e número de massa (A) do átomo X.