Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.458 questões

A partir dos dados extraídos do gráfico responda aos itens abaixo:
Admitindo-se que, para uma certa reação, o segmento AB representa o nível da entalpia dos reagentes e o segmento FG o nível da entalpia dos produtos, podemos afirmar que:
1. A reação direta é exotérmica.
2. A energia de ativação desse processo é representada pelo segmento FG. 3. O perfil do gráfico permite afirmar que a reação direta representa uma reação de combustão. 4. A variação de entalpia (energia) de reação direta é de ΔH = – 600,00 kJ. 5. A reação inversa é exotérmica.
Assinale a alternativa que indica todas as afirmativas corretas.
Quando o dicromato de sódio, Na2 Cr2 O7 , numa reação química se transforma em sulfato de crômio, Cr2 (SO4 ) 3 , cada átomo de crômio:
Acerca de eletroquímica e de processos de oxidação e redução, julgue o item
Em uma célula eletroquímica, ânodo é o eletrodo no
qual ocorre a oxidação e cátodo é o eletrodo no qual
ocorre a redução.
Acerca de eletroquímica e de processos de oxidação e redução, julgue o item
Célula eletroquímica é um dispositivo ou sistema que
converte energia elétrica em química ou vice‐versa,
formado por dois eletrodos em contato com um
eletrólito. Em uma pilha galvânica, um conjunto de
células eletroquímicas é usado para a produção de
eletricidade como resultado de uma reação química
espontânea. Em uma célula eletrolítica, a corrente
elétrica é usada para produzir uma transformação
química.
Acerca de eletroquímica e de processos de oxidação e redução, julgue o item
As espécies capazes de fixar elétrons são agentes
redutores e as capazes de doar elétrons são agentes
oxidantes. Um agente redutor age recebendo elétrons
de uma espécie. Com isso, ele reduz essa espécie e ele
próprio é oxidado.
Acerca de eletroquímica e de processos de oxidação e redução, julgue o item
As reações de oxidação e redução envolvem a
transferência de elétrons de uma espécie molecular ou
iônica para outra. A redução é a perda de elétrons por
uma dada espécie e a oxidação é a fixação desses
elétrons por uma determinada espécie.
Acerca de eletroquímica e de processos de oxidação e redução, julgue o item
Eletroquímica é a parte da química que trata do uso das
reações químicas para produzir eletricidade, das
capacidades relativas de oxidação e redução e do uso da
eletricidade para produzir uma transformação química.
No que se refere à termoquímica, a reações exotérmicas e endotérmicas e à variação de entalpia, julgue o item
Um processo endotérmico ocorre com absorção de calor
(ΔH < 0), como, por exemplo, no processo de
congelamento da água. Um processo exotérmico ocorre
com liberação de calor (ΔH > 0), como, por exemplo, no
processo de vaporização da água.
No que se refere à termoquímica, a reações exotérmicas e endotérmicas e à variação de entalpia, julgue o item
Quando uma reação química se realiza à pressão
constante, a quantidade de calor liberado ou absorvido
é expressa pela variação da entalpia do sistema. Seu
sinal algébrico indica se a reação é endotérmica ou
exotérmica.
No que se refere à termoquímica, a reações exotérmicas e endotérmicas e à variação de entalpia, julgue o item
Grande parte dos processos químicos é conduzida à
pressão constante ou quase constante. Com isso, o calor
absorvido em uma reação é igual à soma do aumento na
energia do sistema com qualquer trabalho realizado
sobre o sistema.
No que se refere à termoquímica, a reações exotérmicas e endotérmicas e à variação de entalpia, julgue o item
O calor absorvido durante um processo a volume
constante, em que nenhum trabalho de expansão pode
ser realizado, é igual à variação da energia do sistema.
No que se refere à termoquímica, a reações exotérmicas e endotérmicas e à variação de entalpia, julgue o item
A quantidade de calor que é absorvida ou liberada por
um sistema durante uma variação independe de como a
variação ocorre.
No que se refere à termoquímica, a reações exotérmicas e endotérmicas e à variação de entalpia, julgue o item
A termoquímica é o ramo da química sobre a relação
entre calor e transformações químicas. A quantidade de
calor liberado ou absorvido em um sistema reagente
depende da natureza da reação, das quantidades dos
reagentes e das condições impostas na mistura
reagente.
I. Tempo de meia-vida biológico
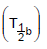 II. Tempo de meia-vida efetivo
II. Tempo de meia-vida efetivo 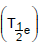 III. Tempo de meia-vida físico ou da partícula
III. Tempo de meia-vida físico ou da partícula 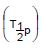
A figura abaixo ilustra o decaimento do estrôncio 85, após ter sido injetado em uma pessoa.
Decaimento do radionuclídeo em um paciente
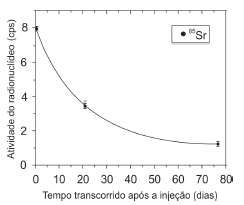
(Adaptado de: Haquin et al., 2004. Biological Half-Life Measurements of Radioactive Strontium in Hormonal-Resistant Prostate Cancer Patients)
Sabendo que o tempo de meia-vida efetivo representa o tempo necessário para um radionuclídeo (contido em um sistema biológico) reduzir a sua atividade pela metade, um resultado combinado entre o decaimento radioativo e a meia‐vida biológica é expresso por:
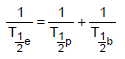
Sabendo que o tempo de meia-vida do Sr-85 vale 1.440 horas, o tempo de meia-vida efetivo aproximado deste radionuclídeo, no interior do paciente que se encontra em tratamento radioterápico é, aproximadamente, igual a
Ela suspeitou que havia se contaminado com um isótopo radioativo do césio. Preocupada, procurou auxílio técnico especializado que constatou que as queimaduras não foram provocadas por radiação ionizante.
Como atualmente esses aparelhos não possuem elementos radioativos, a radiação é do tipo
Ca(OH)2 + HCI → CaCl2 + H2O
Com base nessa reação química, é correto afirmar que
I CH₂O + O₂ → CO₂ + - 570,70 H₂O
II C(grafite) + O₂(g) → CO₂(g) -394,00
III HgO → Hg + 1/2O₂+ 90,70
IV CO(g) + 1/2O₂ → CO₂(g) - 283,00
V HCl + H₂O(l) → H₃O+ + -75,00 Cl'
Os itens de I a V podem ser classificados, respectivamente, como reação:
Na pilha de corrosão formada por mesmo material e mesmo eletrólito, porém com teores de gases dissolvidos diferentes, também chamada de corrosão por aeração diferenciada, sujeiras, trincas e fissuras atuam como focos para a corrosão, levando à corrosão localizada.
Na pilha de corrosão formada por materiais de natureza química diferente, também denominada corrosão galvânica, ocorre uma corrosão eletroquímica, em presença de um eletrólito, tão mais intensa quanto mais afastados na série galvânica estiverem os pares em contato.