Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.447 questões
NH3 (g) + HCl (g) → NH4 Cl (s) ∆H0 = –176 kJ N2 (g) + 3H2 (g) → 2NH3 (g) ∆H0 = –92,2 kJ N2 (g) + 4H2 (g) + Cl2 (g) → 2NH4 Cl (s) ∆H0 = –628,9 kJ
Com base nas equações, é correto afirmar que a entalpia de reação de síntese do gás cloreto de hidrogênio é, em quilojoules, aproximadamente igual a:
X (s) / X2+ (1,05 mol/L) // Y2+ (1,10 mol/L) / Y (s)
Sobre a notação descrita, foram feitas as seguintes afirmações. I. As duas barras (//) indicam a ponte salina. II. X representa o eletrodo do anodo e Y, o eletrodo do catodo para reações espontâneas. III. O potencial da pilha se encontra em condição diferente do padrão.
Estão corretas as afirmações:
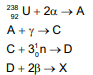
Nessas condições, é correto afirmar que o elemento X é a espécie:
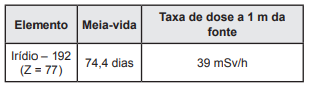
Considerando que a taxa de dose cai com o inverso do quadrado da distância, a taxa de dose a 3,4 m da fonte após 148,8 dias é igual a:
Analise as seguintes reações de oxirredução:
I. _ H2 S(g) + _ SO2 (g) → _ S(s) + _ H2 O(l)
II. _ B2 O3 + _ Mg(s) → _ B(s) + _ MgO(s)
A alternativa que representa as equações balanceadas é:
Observe a Tabela com dados sobre a temperatura de fusão (°C), calor latente de fusão (°C/g) abaixo.
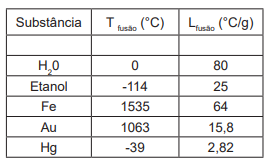
Assinale a alternativa que possui a afirmação correta.
Considere a Tabela de potencial padrão de redução para algumas semicelas abaixo para responder a questão.

A força eletromotriz de uma pilha galvânica formada por duas semicelas nos estados padrões e conectadas por uma ponte salina pode ser estimada a partir da tabela de potenciais de redução.
O módulo da força eletromotriz para uma pilha de Cu e Zn, em V, é


