Questões de Química - Transformações Químicas e Energia para Concurso
Foram encontradas 1.420 questões
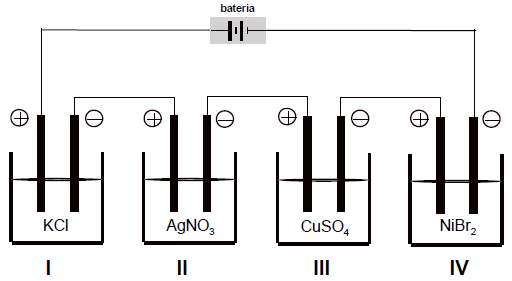
Sabendo-se que os eletrodos são inertes em todas as cubas, é correto afirmar que em
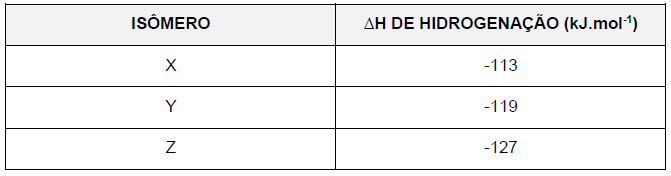
Sobre esses isômeros, é correto afirmar que
O valor da variação de entropia da vizinhança desse sistema a 25°C, em J.K-1 , é:
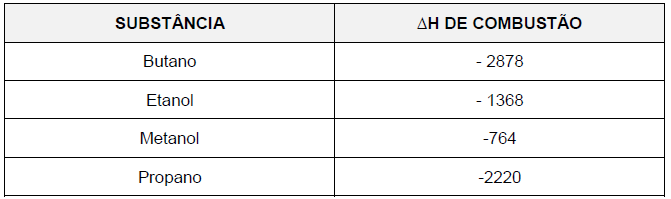
O combustível que lança na atmosfera a maior quantidade de gás poluente, para uma mesma quantidade de energia produzida, é
Tendo em vista que a inclusão de marcadores fotoluminescentes em munição livre de chumbo faz que o disparo de munição marcada dessa maneira produza resíduos luminescentes facilmente identificáveis na presença de luz ultravioleta, julgue o item subsequente, relacionado ao fenômeno de fotoluminescência envolvido nessa aplicação.
A fosforescência é um processo fotofísico lento, pois envolve uma transição radioativa entre estados de mesma multiplicidade.
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
As entalpias padrão de ligação fornecidas permitem determinar que a decomposição de 1,00 mol de H2O2, quando realizada à pressão constante de 1 bar e a 25 ºC, libera quantidade de calor superior a 100 kJ.
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
A reação de decomposição do H2O2 libera maior quantidade de calor quando é realizada à pressão constante de 1 bar do que quando é realizada a volume constante.


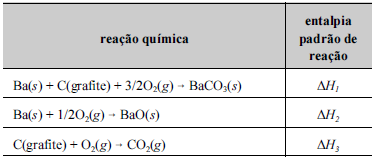
Tendo como referência a figura e os dados da tabela precedentes, julgue o item a seguir.
Se, na queima de um artefato pirotécnico ocorrera decomposição do carbonato de bário, de acordo coma reação química BaCO3(s) → BaO(s) + CO2(g), entãoa entalpia padrão dessa reação de decomposição (ΔHx),calculada a partir dos dados listados na tabela seguinte,será ΔHx = ΔH1 - ΔH2 + ΔH3.
( ) Se ΔG = 0, a reação não ocorre. ( ) Uma reação espontânea ocorre em qualquer sentido (direto e indireto). ( ) Se ΔG < 0, a reação é espontânea no sentido direto (reagentes→ produtos). ( ) Se ΔG > 0, a reação é espontânea no sentido indireto (produtos→reagentes).
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
Com relação a decaimento, considere as seguintes equações:
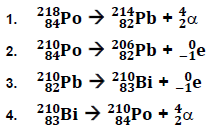
São equações de decaimento:
Para a remoção de cromo hexavalente (Cr6+) pode-se utilizar dióxido de enxofre (SO2). A redução do Cr6+ se dá em meio ácido com pH entre 2 e 3. Após a neutralização com hidróxido de cálcio [Ca(OH)2], em pH 8 a 9, o cromo precipita como hidróxido de cromo III (Cr(OH)3). As reações envolvidas são:
− Redução: 3 SO2 + 2 H2CrO4 + 3 H2O → Cr2(SO4)3 + 5 H2O
− Precipitação: Cr2(SO4)3 + 3 Ca(OH)2 → 2 Cr(OH)3 + 3 CaSO4
− Estequiometricamente é necessário na redução 2,0 g de SO2/g Cr6+ e de 2,0 g de H2SO4 / g Cr6+
− Na precipitação utiliza-se 2,6 g de Ca(OH)2 /g Cr6+
Para tratar um efluente de 8,0 m3 contendo 0,50 g de g Cr6+/L de efluente, o consumo de SO2, H2SO2 e Ca(OH)2 são, respectivamente:
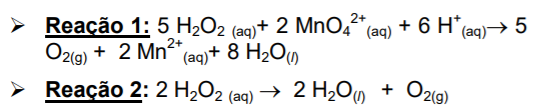
Com relação às informações dadas, podemos afirmar que:
I. A determinação de peróxido é um método complexiométrico. II. A expressão da concentração, em volumes decorre da auto protólise do peróxido. III. Na reação de permanganometria, o peróxido de hidrogênio é o agente redutor. IV. Para este procedimento deve ser empregado um indicador metalocrômico. V. A expressão “volumes de água oxigenada” se deve à geração de oxigênio na sua decomposição.
Estão CORRETAS apenas as afirmativas:
Fe+2(aq) + 2 e- → Fe(s) E° = - 0,44 V Pb+2(aq) + 2 e- → Pb(s) E°= - 0,13 V
E considerando a formação de uma pilha, são feitas as seguintes afirmativas:
I. A reação que ocorre no cátodo é Pb+2(aq) + 2 e- → Pb(s). II. A Pilha pode ser representada por Fe2+(aq) / Fe(s) // Pb2+(aq) / Pb(s). III. A voltagem da pilha é igual a 0,31 V. IV. A reação não é espontânea.
Assinale a alternativa em que todas as afirmativas estão CORRETAS: