Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.539 questões
Um anodo e um catodo são inseridos em uma solução eletrolítica. Sabe-se que o potencial de equilíbrio do catodo é 1,5 vezes o potencial de equilíbrio do anodo.
Observando que a força eletromotriz entre os eletrodos é V0, o potencial de equilíbrio do catodo, em função de V0, é
Uma amostra de minério (20,00 g) foi previamente solubilizada com uma mistura de ácidos inorgânicos e posteriormente diluída com água para ajustar seu volume para 1,00 L. Dessa solução, separam-se 250,00 mL que foram colocados em uma célula de um sistema eletrogravimétrico. Após a aplicação de um potencial adequado, o cobre da solução foi depositado, seletivamente, na superfície de um eletrodo de platina (em forma de rede para se ter elevada área superficial).
Se a massa de cobre depositada no eletrodo foi igual a 1,55 g, a percentagem (m/m) no minério é
O enxofre do H2S dissolvido em água pode ser precipitado por um processo eletrolítico, como indicado na equação a seguir.
H2 S(aq) + I2(aq) → S(s) + 2H+ (aq) + 2I- (aq)
Considere o texto e a figura a seguir para responder à questão.
Um quarto de quilograma de uma amostra de matéria desconhecida, inicialmente no estado sólido a 35°C, é aquecido à taxa de 150 calorias por minuto, e a variação de temperatura foi acompanhada conforme apresentado no gráfico da figura a seguir:

Considere que o combustível empregado num veículo leve seja o etanol puro e que a reação de combustão desse combustível, no motor do veículo, seja completa. A tabela a seguir, apresenta informações acerca da energia, em termos de entalpia das ligações químicas.

ATKINS, P.; JONES, L. Chemical principles, the quest for insight. 6. ed. New York. P.300 (Adaptado).
Com bases nessas informações, a entalpia de combustão do etanol, em kj/mol é
aproximadamente igual a
Considere as reações a seguir a 25°C e 1 atm.

Com base nessas informações e considerando que nas reações 2 e 3 o valor de ΔH é referente à reação balanceada com os menores números inteiros, determine o valor aproximado da entalpia da reação de hidrogenação do acetileno.
Observação: Para o cálculo do valor de ΔH da reação de hidrogenação do acetileno, esta deverá ser balanceada com os menores números inteiros que fazem o seu correto balanceamento.
Considere o texto a seguir para responder à questão.
A reação de ionização do ácido clorídrico, HCl(g) → H+(aq) + Cl-(aq) , processa-se a 25°C e 1 atm e são conhecidos os seguintes valores termodinâmicos ΔH = -75 kj/mol e ΔS = -131, 5 J/(mol. K).
Considere o texto a seguir para responder à questão.
A reação de ionização do ácido clorídrico, HCl(g) → H+(aq) + Cl-(aq) , processa-se a 25°C e 1 atm e são conhecidos os seguintes valores termodinâmicos ΔH = -75 kj/mol e ΔS = -131, 5 J/(mol. K).
Acerca da entropia da reação, analise as asserções a seguir:
O valor negativo de ΔS indica que um mol de H+(aq) mais um mol de Cl-(q) são menos desordenados que um mol de HCl gasoso separado do solvente água.
PORQUE
Os íons aquosos são mais desordenados que compostos no estado gasoso.
Referente às asserções, é correto afirmar que
O hexafluoreto de urânio é uma substância de importância tecnológica, sendo utilizado como matéria prima para obtenção e enriquecimento do urânio metálico. A figura a seguir apresenta o diagrama de fases dessa substância:

IAEA - International Atomic Energy Agency. Disponível em: https://www.iaea.org (Adaptado).
Uma amostra de 704 g de hexafluoreto de urânio, inicialmente a 30°C e 1 atm, foi submetida aos seguintes procedimentos, realizados em sequência, em um laboratório:
1. aquecimento à pressão constante até 100°C;
2. compressão isotérmica (100°C) até 7 atm;
3. resfriamento à pressão constante (7 atm) até 20°C.
No dia 3 de setembro, a Coreia do Norte realizou o seu teste mais potente até hoje com o que seria uma bomba de hidrogênio. A potência estimada da explosão foi de 250 quilotons, ou seja, 16 vezes a força da bomba atômica que destruiu a cidade japonesa de Hiroshima em 1945.
Disponível em: http://www.folha.uol.com.br/mundo (com adaptações).
Com referência ao texto, preencha as lacunas e assinale a alternativa correta.
“No instante em que uma bomba de hidrogênio explode ocorre uma reação de___________
nuclear, enquanto que em uma bomba atômica - como a de Hiroshima -, ocorre uma reação
de_______________nuclear”.
Uma reação em fase gasosa se propaga em duas etapas, como indicado pelo diagrama energético a seguir:
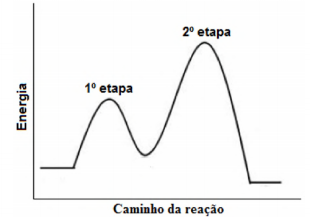
Em relação ao tema, assinale a alternativa
correta.
Considere os seguintes potenciais normais de redução, de três metais genéricos X, Y e Z, respectivamente:
X2+ + 2 e- → X° E° = - 0 ,7 5 V
Y2+ + 2 e- → Y° E° = + 0 ,3 5 V
Z+ + e- → Z° E° = + 0 ,8 0 V
Assinale a alternativa que apresenta o melhor agente oxidante.
Considere a pilha ilustrada na figura a seguir, em que as soluções de ZnSO4 e CuSO4 foram empregadas com concentração inicial de 1 mol/L.
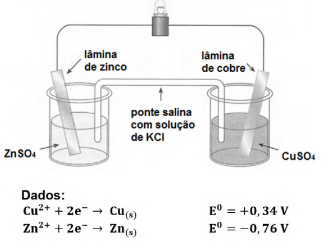
Acerca da situação apresentada, assinale a alternativa INCORRETA.
O potencial padrão de redução do Fe3+ (ver equação I) é +0,77 V em relação ao eletrodo padrão de hidrogênio (EPH). O eletrodo de referência de calomelano, ou Hg/Hg2Cℓ2 (KCℓsat), tem potencial de redução (ver equação II) igual a +0,24 V em relação ao EPH.
I - Fe3+ (aq) + e → Fe2+ (aq) E° = +0,77 V
II - Hg2Cℓ2(s) + e → 2 Hg(ℓ) + 2 Cℓ- (aq) E° = +0,24 V
Assim sendo, o potencial de redução padrão do Fe3+, em V, em relação ao eletrodo de referência de calomelano é
Um eletrodo é formado por um fio de prata recoberto com uma camada de AgBr(s). A reação de redução característica do eletrodo é representada na equação abaixo.
AgBr(s) + e ⇋ Ag(s) + Br - (aq)
A aplicação desse eletrodo em potenciometria é de
A reação representada abaixo é a titulação potenciométrica de Cr2+ com solução padrão de Ce4+, usando um eletrodo indicador de Pt.
Cr2+ + Ce4+ → Cr3+ + Ce3+
Antes do ponto de equivalência, quando a concentração de Cr2+ é 100 vezes maior que a de Cr3+, o potencial medido, em V (numa temperatura T em que RT/F = 0,06 V), é
Dados
Potenciais em relação ao eletrodo padrão de hidrogênio.
Cr3+ + e → Cr2+ Eo = - 0,41 V
Ce4+ + e → Ce3+ Eo
= +1,44 V