Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.539 questões
A corrosão eletroquímica é a de maior presença nos mais diversos ambientes, é para tal processo corrosivo que se prepara a superfície metálica de torres, com o objetivo de impedir a formação de pilhas ou células corrosivas. Os processos de corrosão, nesse caso, caracterizam-se por:
I. Acontecerem necessariamente sem a presença de água líquida.
II. Acontecerem em temperaturas abaixo do ponto de orvalho, sendo em maior parte na temperatura ambiente.
III. Acontecerem devido à formação de pilhas de corrosão ou células eletroquímicas.
Estão corretas as afirmativas.
Dados massas atômica (g mol-1): Fe = 56; O = 16.
Em nosso cotidiano, várias reações químicas e processos físicos envolvem trocas de energia na forma de calor. Por exemplo, quando queimamos o carvão, temos uma reação química de combustão com liberação de energia na forma de calor.
Sobre as reações químicas é CORRETO afirmar que:
I. O campo que estuda essas trocas de calor nas reações químicas e nas mudanças de estado físico é a Termoquímica.
II. Processos endotérmicos são aqueles em que ocorre a absorção de calor.
III. No processo endotérmico, a entalpia (energia global simbolizada por H) dos produtos é maior que a entalpia dos reagentes, a variação da entalpia (∆H) ou o calor envolvido nos processos endotérmicos será sempre um valor negativo.
Está(ão) CORRETAS:
A produção comercial do ácido nítrico envolve as seguintes reações químicas:
I. 4NH3(g) + 5O2(g ) → 4NO(g) + 6H2O(g)
II. 2NO(g) + O2(g) → 2NO2(g)
III. 3NO2(g) + H2O(L) → 2HNO3(aq) + NO(g)
É correto afirmar que são reações de oxirredução as descritas em:
A formação do gás monóxido de nitrogênio (NO) a partir de gás nitrogênio (N2 ) e gás oxigênio (O2 ) fornece um exemplo prático importante das variações na constante de equilíbrio e velocidade de reação com a temperatura. Considere a equação de equilíbrio e a variação da entalpia padrão a seguir para a reação de formação do gás monóxido de nitrogênio.
½ N2(g) + ½ O2(g)  NO(g) ∆H0 = +90,4 kJ
NO(g) ∆H0 = +90,4 kJ
Sobre o equilíbrio químico envolvido no processo, assinale com V as afirmativas verdadeiras e com F as falsas.
( ) O aumento da temperatura do sistema produz mais monóxido de nitrogênio.
( ) O aumento da temperatura diminui o valor numérico da constante de equilíbrio.
( ) A adição de NO ao sistema aumenta o valor numérico da constante de equilíbrio.
( ) A adição de O2 ao sistema produz mais monóxido de nitrogênio.
Assinale a sequência CORRETA.
Quimicamente, o gás bromo (Br2 ) pode reagir com gás hidrogênio (H2 ) sob aquecimento ou ação da luz, produzindo brometo de hidrogênio (HBr), cuja solução aquosa (ácido bromídrico) corresponde a um hidrácido muito forte.
Considere as equações termoquímicas a seguir.
NH3(g) + HBr(g) → NH4Br(s) H0 = –188,32 kJ
N2(g) + 3H2(g) → 2NH3 (g) H0 = –92,2 kJ
2NH4Br(s) → N2(g) + 4H2(g) + Br2(g) H0 = +541,66 kJ
Baseando-se nessas equações termoquímicas, é correto
afirmar que o valor aproximado da entalpia de reação da
síntese do gás brometo de hidrogênio é igual a:
Os métodos potenciométricos de análise baseiam-se na medida do potencial de células eletroquímicas, sem o consumo apreciável de corrente. Seus valores absolutos de potencial de meia-célula não podem ser determinados no laboratório. Isto é, apenas os potenciais de célula relativos podem ser medidos experimentalmente.
Numere a COLUNA II de acordo com a COLUNA I relacionando os componentes de uma célula às suas principais características.
COLUNA I
1. Eletrodo de referência
2. Ponte salina
3. Eletrodo indicador
COLUNA II
( ) O potencial de junção deve ser extremamente baixo, e, consequentemente, no processamento da célula pode ser desprezado.
( ) Tem um potencial que varia de uma forma conhecida com alterações na concentração de um analito.
( ) O potencial não varia sob temperatura constante, independentemente da composição da solução do analito.
Assinale a sequência CORRETA.
Após a leitura do enunciado apresentado a seguir, identifique a afirmação correta:
A pressão de entrega, densidade e poder calorífico do gás combustível para a realização do dimensionamento devem ser obtidos juntos à entidade devidamente autorizada pelo poder público a distribuir gás combustível. Como parâmetros de cálculo normatizados, para o gás natural (GN) devemos adotar:
O jeans com aspecto “desbotado” pode ser obtido pela oxidação parcial do índigo impregnado no tecido (denim), utilizando-se uma solução de KMnO4, como ilustrado pelo esquema reacional a seguir. Devido à formação de MnO2, sólido castanho insolúvel em água, um outro reagente deve ser usado para que ele não impregne o tecido.
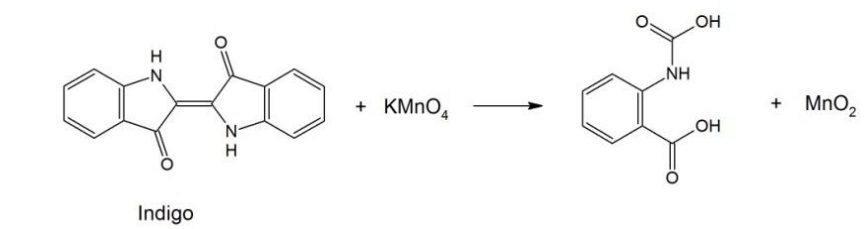
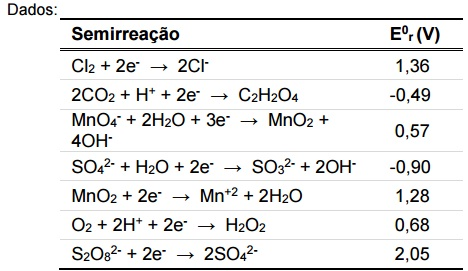
De acordo com os potenciais de redução fornecidos na tabela
ao lado, assinale a alternativa que apresenta substâncias que
podem ser usadas para transformar o MnO2 na espécie
solúvel Mn+2
.