Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.539 questões
O professor propôs, como introdução ao estudo das reações de oxirredução, um experimento bem simples para que o aluno tenha condições de observar um fenômeno que envolve mudanças visuais muito nítidas desse tipo de reação.
No experimento, o aluno deve acrescentar um comprimido de vitamina C não efervescente a uma solução de iodo (farmacêutica) e adicionar água. Nessa reação a vitamina C que é oxidada promove um descoramento da solução de iodo que é reduzido.
A transformação que ocorre no iodo pode ser codificada em uma linguagem química como
No estudo de Termoquímica, o professor propôs uma experiência para determinação do calor de combustão do álcool etílico (etanol).
O procedimento experimental e as anotações de um grupo de alunos estão apresentados a seguir:
I. preparar a lamparina colocando uma quantidade suficiente de álcool etílico para que a combustão possa ser realizada.
II. determinar a massa do sistema “álcool-lamparina” (mi) e anotar no caderno. Valor anotado mi= 180,0 g;
III. determinar a massa do erlenmeyer (me) vazio e anotar no caderno. Valor anotado me = 200,0 g;
IV. medir 100 mL de água, que correspondem a 100 g, em uma proveta e transferir para o erlenmeyer. Envolver as paredes do erlenmeyer com jornal e prender com fita crepe. Colocar em um suporte;
V. medir a temperatura da água (Ti) e anotar o valor. Valor anotado Ti = 25°C; VI. acender a lamparina e aquecer a água do erlenmeyer, durante 5 minutos. Após esse tempo, apagar a lamparina e medir a temperatura da água (Tf) e anotar o valor. Valor anotado Tf = 40°C;
VII. Medir, após algum tempo, a massa do sistema “álcool-lamparina”(mf) após a combustão. Valor anotado mf = 160,0 g.
Utilizando os dados anotados e a constante 1,0 cal.g–1 .°C –1 como calor específico da água e a constante 0,2 cal.g–1 .°C –1 como calor específico do vidro, os alunos devem chegar a um valor para o calor de combustão do álcool, em cal.g–1 , de
Considere o quadro abaixo.
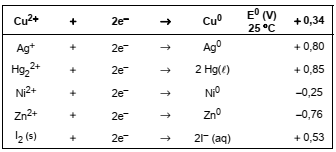
Deseja-se proteger contra a corrosão, chapas de cobre. Analisando-se apenas o potencial padrão de redução deve-se utilizar
A decomposição térmica do calcário produz cal e gás carbônico como mostra a reação e a tabela abaixo.

Está correto afirmar que a
Considere a reação 5 Fe2+ + MnO4− + 8H+ → 5 Fe3+ + Mn2+ + 4 H2O utilizada em uma titulação redox para determinação do teor de ferro em 2 g de uma amostra de minério contendo ferro. Nessa titulação foram gastos 47,5 mL de solução 0,02 mol . L−1 de KMnO4 para alcançar o ponto de equivalência. A porcentagem em massa de ferro na amostra é
Dados:
Massas molares (g . mol−1)
K = 39;
Fe = 56;
Mn = 55; O = 16;
H = 1
As baterias primárias de lítio são alternativas de fornecimento de energia elétrica de longa duração podendo durar até oito anos. Por isso são utilizados em marca-passo cardíaco. A reação global que ocorre nesse tipo de bateria está representada a seguir.
Dados os potenciais de redução:
Li+ (aq) + e− → Li(s); E° = −3,05 V
I2 (s) + 2e− → 2 I− (aq); E° = + 0,54 V
2 Li(s) + 1 I2(s) → 2 LiI(s)
Com relação a esta pilha afirma-se:
I. O potencial da pilha é de 3,59 V.
II. O cátodo é o lítio metálico.
III. No ânodo ocorre a oxidação do iodo.
IV. O oxidante é o iodo I2.
Está correto o que se afirma APENAS em
Está representado abaixo um diagrama de entalpia para a reação Li(s) + ½ F2(g) → LiF(s).
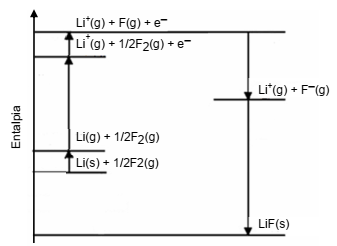
Essa reação é
Atenção: Considere as semi-reações de redução abaixo para responder à questão.
NO-3 + 4H+ + 3e- → NO + 2H2O; E0 = +0,96 V
Cu2+ + 2e− → Cu; E0 = +0,34 V
Atenção: Considere a equação de decomposição da nitroglicerina abaixo para responder à questão.
4C3H5N3O9 (ℓ) → 6N2 (g) + 12CO2 (g) + 10H2O (g) + O2 (g) + 6 161 kJ
Deseja-se efetuar um banho de prata em um anel utilizando-se para tal, uma solução de nitrato de prata. O tempo necessário em segundos para depositar 1,08 g de prata utilizando-se uma corrente contínua de 1 ampère é, em segundos (s),
Dados:
Reação no cátodo: Ag+ (aq) + e− → Ag(s)
Constante de Faraday = 96 500 Coulomb/mol de elétron
Massa atômica da prata (Ag) = 108 g/mol
A bateria de chumbo é muito utilizada na indústria automotiva e no funcionamento de no-breaks usados na alimentação elétrica de computadores.
As duas semirreações de redução balanceadas desse sistema são representadas abaixo e são fornecidos os respectivos potenciais padrão (em V):
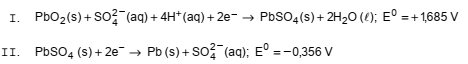
Na descarga dessa bateria, a diferença de potencial do sistema é de, aproximadamente,
Atenção: Considere as informações abaixo para responder a questão.
Breu (ácido abiético, fórmula molecular C19H29COOH) e pentaeritritol (2,2-Bis (hidroximetil)1,3-propanodiol; fórmula molecular C5H12O4) reagem, eliminando água, para formar o composto I, muito utilizado na indústria de tintas e de borracha.

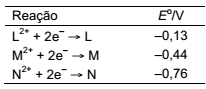
As pilhas eletroquímicas são dispositivos que produzem energia elétrica a partir de reações espontâneas de oxirredução que é medida pelo potencial de redução. De acordo com os potenciais de redução na tabela a seguir, assinale a afirmação CORRETA nas condições normais?
Nos Estados Unidos (USA), os postos de combustíveis automotivos geralmente disponibilizam gás (CH4, metano), metanol (CH3OH, álcool metílico) e gasolina (C8H18, fórmula química aproximada), respectivamente. A reação de combustão completa e energia liberada na forma de calor desses combustíveis são apresentadas a seguir:
I. CH4(g) + O2(g) → CO2(g) + H2O(g)
ΔHm = –960 kJ mol–1
II. CH3OH(ℓ) + 3/2 O2(g) → CO2(g) + 2H2O(g) ΔHm = – 670 kJ mol-1
III. C8H18(ℓ) + 25/2 O2(g) → 8CO2(g) + 9H2O(g) ΔHm = – 5700 kJ mol-1
Com base nos dados estabeleça a ordem
decrescente dos combustíveis em relação a energia
liberada com uma mesma quantidade em massa.