Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.445 questões
Em nosso cotidiano, várias reações químicas e processos físicos envolvem trocas de energia na forma de calor. Por exemplo, quando queimamos o carvão, temos uma reação química de combustão com liberação de energia na forma de calor.
Sobre as reações químicas é CORRETO afirmar que:
I. O campo que estuda essas trocas de calor nas reações químicas e nas mudanças de estado físico é a Termoquímica.
II. Processos endotérmicos são aqueles em que ocorre a absorção de calor.
III. No processo endotérmico, a entalpia (energia global simbolizada por H) dos produtos é maior que a entalpia dos reagentes, a variação da entalpia (∆H) ou o calor envolvido nos processos endotérmicos será sempre um valor negativo.
Está(ão) CORRETAS:
O coordenador de um laboratório decide utilizar uma técnica eletroquímica para realizar a determinação de chumbo em amostras de efluente. Com base nessa informação, julgue o item seguinte acerca de eletroquímica.
Aferições de pH em soluções são comumente realizadas
utilizando-se um potenciômetro conectado a um eletrodo de
vidro combinado, o qual é composto, resumidamente, por dois
eletrodos de prata-cloreto de prata e pela membrana de vidro.
O coordenador de um laboratório decide utilizar uma técnica eletroquímica para realizar a determinação de chumbo em amostras de efluente. Com base nessa informação, julgue o item seguinte acerca de eletroquímica.
Utilizando-se medidas potenciométricas, a determinação de
chumbo requer, necessariamente, o uso de padrões com
concentrações conhecidas para construção de uma curva
analítica.
O coordenador de um laboratório decide utilizar uma técnica eletroquímica para realizar a determinação de chumbo em amostras de efluente. Com base nessa informação, julgue o item seguinte acerca de eletroquímica.
Pode-se realizar a determinação de chumbo nas amostras por
meio de um sistema eletroquímico composto por um eletrodo
de referência prata-cloreto de prata e um eletrodo indicador de
primeira classe constituído de uma placa de chumbo.
O coordenador de um laboratório decide utilizar uma técnica eletroquímica para realizar a determinação de chumbo em amostras de efluente. Com base nessa informação, julgue o item seguinte acerca de eletroquímica.
Quando são realizadas medidas com o eletrodo de vidro de
soluções muito ácidas, podem ser observados valores de pH
menores que os reais, que são conhecidos como erros ácidos.
Sua principal origem consiste na saturação da membrana de
vidro por íons H+
.
A produção comercial do ácido nítrico envolve as seguintes reações químicas:
I. 4NH3(g) + 5O2(g ) → 4NO(g) + 6H2O(g)
II. 2NO(g) + O2(g) → 2NO2(g)
III. 3NO2(g) + H2O(L) → 2HNO3(aq) + NO(g)
É correto afirmar que são reações de oxirredução as descritas em:
A formação do gás monóxido de nitrogênio (NO) a partir de gás nitrogênio (N2 ) e gás oxigênio (O2 ) fornece um exemplo prático importante das variações na constante de equilíbrio e velocidade de reação com a temperatura. Considere a equação de equilíbrio e a variação da entalpia padrão a seguir para a reação de formação do gás monóxido de nitrogênio.
½ N2(g) + ½ O2(g)  NO(g) ∆H0 = +90,4 kJ
NO(g) ∆H0 = +90,4 kJ
Sobre o equilíbrio químico envolvido no processo, assinale com V as afirmativas verdadeiras e com F as falsas.
( ) O aumento da temperatura do sistema produz mais monóxido de nitrogênio.
( ) O aumento da temperatura diminui o valor numérico da constante de equilíbrio.
( ) A adição de NO ao sistema aumenta o valor numérico da constante de equilíbrio.
( ) A adição de O2 ao sistema produz mais monóxido de nitrogênio.
Assinale a sequência CORRETA.
Os métodos potenciométricos de análise baseiam-se na medida do potencial de células eletroquímicas, sem o consumo apreciável de corrente. Seus valores absolutos de potencial de meia-célula não podem ser determinados no laboratório. Isto é, apenas os potenciais de célula relativos podem ser medidos experimentalmente.
Numere a COLUNA II de acordo com a COLUNA I relacionando os componentes de uma célula às suas principais características.
COLUNA I
1. Eletrodo de referência
2. Ponte salina
3. Eletrodo indicador
COLUNA II
( ) O potencial de junção deve ser extremamente baixo, e, consequentemente, no processamento da célula pode ser desprezado.
( ) Tem um potencial que varia de uma forma conhecida com alterações na concentração de um analito.
( ) O potencial não varia sob temperatura constante, independentemente da composição da solução do analito.
Assinale a sequência CORRETA.
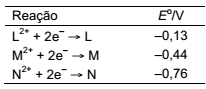
As pilhas eletroquímicas são dispositivos que produzem energia elétrica a partir de reações espontâneas de oxirredução que é medida pelo potencial de redução. De acordo com os potenciais de redução na tabela a seguir, assinale a afirmação CORRETA nas condições normais?
Nos Estados Unidos (USA), os postos de combustíveis automotivos geralmente disponibilizam gás (CH4, metano), metanol (CH3OH, álcool metílico) e gasolina (C8H18, fórmula química aproximada), respectivamente. A reação de combustão completa e energia liberada na forma de calor desses combustíveis são apresentadas a seguir:
I. CH4(g) + O2(g) → CO2(g) + H2O(g)
ΔHm = –960 kJ mol–1
II. CH3OH(ℓ) + 3/2 O2(g) → CO2(g) + 2H2O(g) ΔHm = – 670 kJ mol-1
III. C8H18(ℓ) + 25/2 O2(g) → 8CO2(g) + 9H2O(g) ΔHm = – 5700 kJ mol-1
Com base nos dados estabeleça a ordem
decrescente dos combustíveis em relação a energia
liberada com uma mesma quantidade em massa.