Questões de Química - Transformações Químicas e Energia para Concurso
Foram encontradas 1.420 questões
___ P + ___ HNO3 + __ H2O →__ H3PO4 + 5 NO
Após balanceamento, a soma dos coeficientes estequiométricos dos reagentes é __________. Nesta reação, o __________sofre oxidação e o __________sofre redução.
Assinale a alternativa que apresenta as palavras que preenchem CORRETAMENTE as lacunas, na ordem em que aparecem no texto:
N2O5(g) + H2O(l) → 2 HNO3(aq)
Utilizando as equações termoquímicas:
N2(g) + 3 O2(g) + H2(g) → 2 HNO3(aq) ∆H= – 415 kJ 2 H2(g) + O2(g) → 2 H2O (l) ∆H= – 572 kJ 2 N2(g) + 5 O2(g) → 2 N2O5(g) ∆H = + 22 kJ
Assinale a alternativa que contém o valor da entalpia envolvida na obtenção de quatro mols de ácido nítrico:
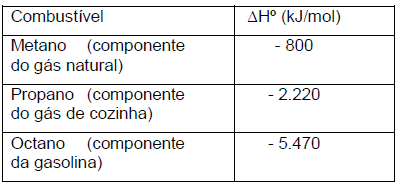
Com base nesses dados, são feitas as seguintes afirmativas:
I. O poder calorífico do Propano é maior que do Octano. II. A queima de um mol de Metano absorve cerca de 50 kJ de energia. III. A energia proveniente da queima de 1 kg de Metano é cerca de 2,8 vezes menor que a energia da queima de 1 kg de Propano.
Assinale a alternativa em que toda(s) a(s) afirmativa(s) está(ão) CORRETA(S):
A proteção catódica é um método utilizado para a proteção de estruturas. Com isso, tubulações e tanques de estocagem, entre outros, são protegidos por esse método. Em uma aula de química, deseja-se estudar a proteção da corrosão de um equipamento constituído basicamente por ferro, empregando-se o método da proteção catódica com o uso de um metal de sacrifício. Nesse contexto, a tabela a seguir mostra os potenciais-padrão de redução (E°) de algumas espécies.

Considerando o texto acima, assinale a alternativa que apresenta, correta e respectivamente, essas transformações.
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (g) ΔH1 CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (l) ΔH2
Assinale a alternativa que apresenta a relação entre essas variações de entalpia.
Texto para a questão.
Curvas de solubilidade em água em função da temperatura para algumas substâncias

Texto para a questão.
A solubilidade é um dos temas mais relevantes da área da química, tanto por sua importância intrínseca quanto pela variedade de fenômenos e propriedades químicas envolvidas em seu entendimento. O processo de solubilização de uma substância resulta da interação entre a espécie que se deseja solubilizar (soluto) e a substância que a dissolve (solvente) e pode ser definida como a quantidade de soluto que dissolve, em uma determinada quantidade de solvente, em condições de equilíbrio. Solubilidade é, portanto, um termo quantitativo.
C. R. Martins, W. A. Lopes e J. B. Andrade. Solubilidade das
substâncias orgânicas. In: Química Nova, v. 36, n.° 8,
2013, p. 1.248-1.255 (com adaptações).
1) H2S (aq) + 4 Cl2 (aq) + 4 H2O (liq)
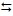 8 HCl (aq) + H2SO4 (aq)
2) 2 Fe(HCO3)2 (aq) + Cl2 (aq) + Ca(HCO3)2 (aq)
8 HCl (aq) + H2SO4 (aq)
2) 2 Fe(HCO3)2 (aq) + Cl2 (aq) + Ca(HCO3)2 (aq) 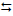 2 Fe(OH)3 (s) + CaCl2
(aq) + 6 CO2 (g)
3) MnSO4 (aq) + Cl2 (aq) + 4 NaOH (aq)
2 Fe(OH)3 (s) + CaCl2
(aq) + 6 CO2 (g)
3) MnSO4 (aq) + Cl2 (aq) + 4 NaOH (aq) 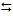 MnO2 (ppt) + 2 NaCl (aq) +
Na2SO4 (aq) + 2H2O (liq)
MnO2 (ppt) + 2 NaCl (aq) +
Na2SO4 (aq) + 2H2O (liq)
Analise as afirmativas a seguir, relacionadas com as reações.
I. Na reação 1, o enxofre sofre oxidação e o cloro é o agente redutor. II. Na reação 2, o ferro sofre oxidação e o cloro sofre redução. III. Na reação 3, o manganês sofre redução e o cloro é o agente oxidante.
Está correto o que se afirma em
A conversão de dióxido de enxofre em trióxido de enxofre é uma das etapas de formação da chuva ácida. Dados termodinâmicos, a 25°C são apresentados na tabela.
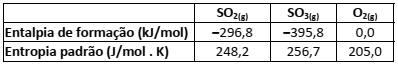
Em relação às características termoquímicas dessa reação, a 25°C, é possível afirmar que
A velocidade de desintegração radioativa de um radioisótopo é de primeira ordem em relação ao número de núcleos radioativos. Uma amostra contendo 5 g do 222Rn sofreu desintegração radioativa durante 6,6 dias e teve sua massa reduzida para 1,5 g. Calcule o tempo de meia‐vida, aproximadamente, em dias, desse radioisótopo.
(Dado: ln 0,30 = –1,2.)
O ciclo de energia global representado no diagrama mostra a variação de entalpia em diversos processos bioquímicos.
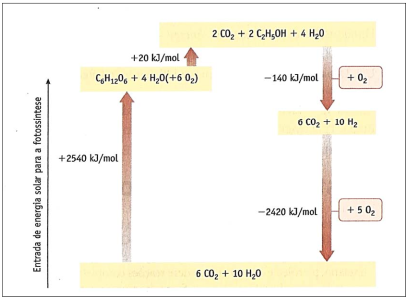
A energia, em kJ, envolvida na produção de um mol de hidrogênio a partir de biomassa é de
Está representado abaixo um diagrama de entalpia para a reação Li(s) + ½ F2(g) → LiF(s).
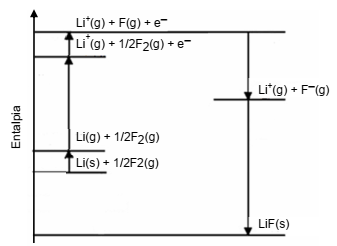
Essa reação é
Atenção: Considere as semi-reações de redução abaixo para responder à questão.
NO-3 + 4H+ + 3e- → NO + 2H2O; E0 = +0,96 V
Cu2+ + 2e− → Cu; E0 = +0,34 V
Atenção: Considere a equação de decomposição da nitroglicerina abaixo para responder à questão.
4C3H5N3O9 (ℓ) → 6N2 (g) + 12CO2 (g) + 10H2O (g) + O2 (g) + 6 161 kJ
Deseja-se efetuar um banho de prata em um anel utilizando-se para tal, uma solução de nitrato de prata. O tempo necessário em segundos para depositar 1,08 g de prata utilizando-se uma corrente contínua de 1 ampère é, em segundos (s),
Dados:
Reação no cátodo: Ag+ (aq) + e− → Ag(s)
Constante de Faraday = 96 500 Coulomb/mol de elétron
Massa atômica da prata (Ag) = 108 g/mol
A bateria de chumbo é muito utilizada na indústria automotiva e no funcionamento de no-breaks usados na alimentação elétrica de computadores.
As duas semirreações de redução balanceadas desse sistema são representadas abaixo e são fornecidos os respectivos potenciais padrão (em V):
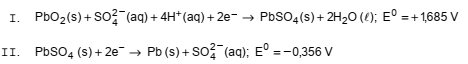
Na descarga dessa bateria, a diferença de potencial do sistema é de, aproximadamente,