Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.539 questões
C2H4(g) + 6 F2(g) → 2 CF4(g) + 4 HF(g)
A partir das entalpias de formação (∆Hof) abaixo:
H2(g) + F2(g) → 2 HF(g) ∆Hof = - 537,6 kJ C(s) + 2 F2(g) → CF4(g) ∆Hof = - 680 kJ 2 C(s) + 2 H2(g) → C2H4(g) ∆Hof = + 52,3 kJ
BROWN, T. L.; LEMAY JR., H. E.; BURSTEN, B. E. Química, a Ciência Central. Tradutor Robson Matos, São Paulo: Pearson Prentice Hall, 2005, 5ª impressão em 2010.
Marque a alternativa que corresponde ao valor de variação de entalpia (∆Hor ) da reação do etileno com o gás flúor.

O número de emissões α (alfa) e β (beta) emitidas pelo U (238) até se estabilizar em Pb (206) está indicado, respectivamente, em:
C(graf) + O2(g) → CO2(g) ∆H = - 395 kJ/mol H2(g) + ½ O2(g) → H2O(g) ∆H = - 290 kJ/mol 2C(graf) + ½ O2(g) + 3 H2(g) → C2H5OH(l) ∆H = - 278 kJ/mol
A entalpia padrão de combustão do etanol é:

O calor envolvido na vaporização de 1 mol de água em kJ é:

Uma pilha formada por Cu e Ag e outra entre Zn e Cu fornecerão os seguintes potenciais, respectivamente:

Em relação a essa célula eletroquímica, é falso afirmar que:
Dessa forma, a tabela que contém valores corretos de Energia de Rede é:
Acerca dessas semirreações, considere as afirmações a seguir:
I – A reação acontecerá de forma espontânea entre Fe3+ e MnO4 - na proporção estequiométrica de 5 para 1. II – O potencial padrão para a reação global será 2,28 V. III – Em uma titulação entre as duas espécies, o potencial do ponto de equivalência será apenas dependente dos potenciais padrão das semirreações e do pH do meio. IV – O íon permanganato é um agente redutor mais fraco que o íon hidrogênio.
Em relação a essas afirmativas, estão CORRETAS
Abaixo está representado o ciclo de Born-Haber para o cloreto de sódio sólido.
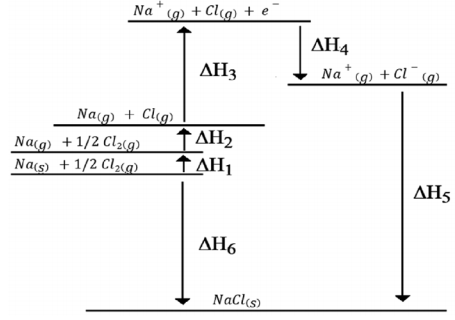
Qual das seguintes alternativas NÃO identifica corretamente a etapa correspondente na ilustração:
Considere as seguintes semirreações:
Fe3+ + e- ⇌ Fe2+ E0 = 0,770 V
MnO4- + 5e- + 8H+ ⇌ Mn2+ + 4H2O E0 = 1,51 V
Acerca dessas semirreações, considere as afirmações a seguir:
I – A reação acontecerá de forma espontânea entre Fe3+ e MnO4- na proporção estequiométrica de 5 para 1.
II – O potencial padrão para a reação global será 2,28 V.
III – Em uma titulação entre as duas espécies, o potencial do ponto de equivalência será apenas dependente dos potenciais padrão das semirreações e do pH do meio.
IV – O íon permanganato é um agente redutor mais fraco que o íon hidrogênio.
Em relação a essas afirmativas, estão CORRETA
O acumulador de Chumbo, também conhecido como bateria chumbo-ácido, é utilizado nos automóveis com objetivo de fornecer corrente elétrica para iniciar a ignição do motor e também para a iluminação.
A reação total pode ser representada pela equação:
αPb(s) + βPbO2 (s) + γH2 SO4 (aq) → ψPbSO4 (s) + ωH2 O(l)
Balanceie a equação esquemática e responda às seguintes questões:
1. a sequência correta dos coeficientes estequiométricos α, β, γ, ψ e ω.
2. agente oxidante.
3. agente redutor.
Assinale a alternativa que responde corretamente às questões numeradas.
Para a reação abaixo:
αCr3+(aq) + βMnO2 (s) + γOH– → ρMn2+(aq) + ψCrO4 2–(aq) + ωH2 O(l)
Balanceie a equação esquemática e assinale a alternativa que indica a sequência correta dos coeficientes estequiométricos α, β, γ, ρ, ψ e ω
dentifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ).
( ) De acordo com o princípio da conservação da energia, a energia não pode ser criada nem destruída, mas somente transformada de uma espécie em outra.
( ) O estado de equilíbrio químico ocorre no momento em que o sistema reacional estaciona e a reação é completada.
( ) Aproximadamente 1,3 kW m-2 da energia radiante solar atinge a Terra, porém somente cerca de 5% desta energia é convertida em carboidratos pela fotossíntese.
( ) Denomina-se “processo exotérmico” aquele que absorve calor e apresenta ∆H > 0.
( ) Aumentar a quantidade dos reagentes é a única maneira de se elevar o valor da constante de equilíbrio de uma reação química.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
Considerando os seguintes dados, calcule o calor de combustão do etino, C2 H2, conhecido comercialmente como acetileno.
2C(grafite) + H2 (g) → C2 H2 (g) ∆Hf0 = +226,73 kJ.mol–1
C(grafite) + O2 (g) → CO2 (g) ∆Hf0 = –393,51 kJ.mol–1
H2 (g) + ½O2 (g) → H2 O(l) ∆Hf0 = –285,83 kJ.mol–1
O calor de combustão do acetileno, (∆Hr0 ), é:

A partir dos dados extraídos do gráfico responda aos itens abaixo:
Admitindo-se que, para uma certa reação, o segmento AB representa o nível da entalpia dos reagentes e o segmento FG o nível da entalpia dos produtos, podemos afirmar que:
1. A reação direta é exotérmica.
2. A energia de ativação desse processo é representada pelo segmento FG. 3. O perfil do gráfico permite afirmar que a reação direta representa uma reação de combustão. 4. A variação de entalpia (energia) de reação direta é de ΔH = – 600,00 kJ. 5. A reação inversa é exotérmica.
Assinale a alternativa que indica todas as afirmativas corretas.
Quando o dicromato de sódio, Na2 Cr2 O7 , numa reação química se transforma em sulfato de crômio, Cr2 (SO4 ) 3 , cada átomo de crômio:
Acerca de eletroquímica e de processos de oxidação e redução, julgue o item
Em uma célula eletroquímica, ânodo é o eletrodo no
qual ocorre a oxidação e cátodo é o eletrodo no qual
ocorre a redução.