Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.539 questões
Observe a figura abaixo e considere a seguinte reação de eletrólise de NaCI aquoso 1 mol L-1:
Semicélula: 2Cl-(aq) → Cl2(g) + 2e-
Semicélula: 2e- + 2H2O → H2(g) + 2OH-(aq)
Célula: 2H2O(aq) + 2Cl-(aq) → H2(g) + Cl2(g) + 2OH-(aq)
Com base nas informações pode-se afirmar que:
Sabendo que um sistema fechado realiza 520 kJ de trabalho e perde 220 kJ de energia na forma de calor, é correto afirmar que:
Considere a célula eletroquímica abaixo.
A diferença de potencial elétrico da célula é dada por: E= 0,5580 + 0,05916 log([Ag+]), em Volts.
Na titulação de 30mL de uma solução de KCI 0,4M foi usada uma solução de AgNO3 0,15M. Sabendo que a diferença de potencial elétrico foi medida pela célula acima, assinale a opção que apresenta o valor da diferença de potencial elétrico, em Volts, após a adição de 20ml da solução de AgNO3.
Dado: KPS,AgCI = 1,8 x 10-10
Em relação à oxirredução, marque a opção INCORRETA:
A entalpia (H) é uma propriedade que pode ser expressa pela seguinte expressão: H = U + PV, em que U é a energia interna, P a pressão e V o volume. Com base nessas informações e sabendo que os gases envolvidos são ideais, determine a variação de entalpia da combustão de 2 mols de glicose que reage num calorímetro de volume constante conforme a reação abaixo e assinale a opção correta.
C6H12O6(s) + 6O2(g) → 6CO2(g) + 6H20(g), △U = -2559 kJ mol-1 e T = 298 K
Dados: R = 8,3145 J K-1 moI-1
Nas reações químicas podem ocorrer a oxidação, quando uma substância ou espécie perde elétrons, e a redução, quando uma substância ou espécie ganha elétrons. A seguir, tem-se o exemplo de uma reação redox:
3MnO2 + KClO3 + 6KOH → 3K2MnO4 + KCI + 3H2O
Com base nisso, analise as afirmativas abaixo, colocando V (verdadeiro) ou F (falso) e assinalando a seguir a opção correta.
I- A variação no número de oxidação do manganês, Mn, muda de +4 para +6, perdendo dois elétrons.
lI- Nenhuma espécie ou substância sofre redução nesta reação.
Ili- O CI5+ é um agente oxidante, já o Mn4+ é o agente redutor.
IV- A equação não está eletronicamente balanceada.
O octano, um composto presente na gasolina, pode queimar até monóxido de carbono se o fornecimento de ar for reduzido, conforme a seguir:
C8H18(I) + 217 O2(g)→ 8 CO(g) + 18 H2O(I)_______△H° = ?
calcule a entalpia padrão de reação da combustão incompleta, no ar, do octano líquido até o gás monóxido de carbono e água líquida e assinale a opção correta.
Considere as seguintes entalpias padrão de combustão:
C8H18(I) + 225 O2(g) → 8 CO2(g) + 18 H2O(I) △H° = -5471,20 kJ.mol-1
C(s) + O2(g) → CO2(g) △H° = -394,00 kJ.mol-1
C(s) + 21 O2(g) → CO(g) △H° = -110,53 kJ.mol-1
A respeito de um sistema adiabático, são dadas as seguintes sentenças:
I- A temperatura no interior do sistema adiabático é constante.
II- Em um processo de expansão adiabática, ocorre um aumento no volume e diminuição na pressão.
III- A energia interna, para um processo de compressão adiabática, é igual à soma das energias na forma de calor e do trabalho realizado sobre o sistema.
É correto o que se afirma em:
3 Cuo(s) + 8 HNO3(aq) → 3 Cu(NO3)2(aq) + 2 NO(g) + 4 H2O(l) (1) 2 NO(g) + O2(g) → 2 NO2(g) (2) NO2(g) ⇌ N2O4(g) (3)
Isso posto, considerando um sistema transparente e fechado, o produto NO2(g) apresenta coloração marrom. O produto N2O4(g) é um gás incolor e, quando o sistema é aquecido acima da temperatura ambiente, o sistema apresenta uma coloração marrom (forte). Em relação à equação três, referente à formação do N2O4(g), é correto afirmar que:
- Combustão completa: C(s) + O2(g) ➝ CO2(g) , ∆H1
- Combustão incompleta: C(s) + 1/2 O2(g) ➝ CO(g) , ∆H2
Responda a alternativa correta.
Levando em conta o comportamento energético da reação da questão anterior, marque a alternativa correta:
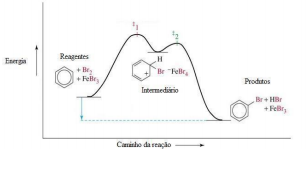
Considerando as informações da figura, pode-se afirmar corretamente que:
Considere que um estudante misturou 20 mL de uma solução aquosa de HCl 1,0 mol/L com 20 mL de uma solução aquosa de NaOH 1,0 mol/L em um calorímetro. A temperatura da mistura reacional aumentou de 20 ºC para 28 ºC.
Partindo do princípio que a perda de calor da mistura reacional para o ambiente é desprezível e que o volume total da mistura é 40 mL, é correto afirmar que a variação da entalpia da reação é mais próxima de
Dados:
Calor específico (c) do meio reacional é igual a 4,18 J/g K.
Densidade (d) da mistura é igual a 1,0 g/mL.
Na área de estudo da potenciometria, sabe-se que o eletrodo indicador é um dispositivo que, imerso na solução contendo o analito, desenvolve um potencial, que depende da atividade do analito. A maioria dos eletrodos indicadores empregados na potenciometria é seletiva em sua resposta.
Um eletrodo que é classificado como eletrodo indicador é o
“É uma ciência voltada para análises das substâncias ou elementos químicos, visando identificá-los e/ou quantificá-los, através de instrumentos ou outros métodos.
Qual a ciência citada acima?
O aquecimento de um balão de São João ocorre pela adição de 900 J de calor. Ao receber este calor, o balão se expande e realiza 422 J de trabalho sobre a atmosfera. Calcule a variação de energia interna e diga se o processo é endotérmico ou exotérmico.
Termodinamicamente podem-se realizar processos ou mudanças no estado de um gás. Leia e analise as informações abaixo.
I - em um processo isotérmico a temperatura do gás é mantida constante.
II - em um processo isobárico a pressão do gás é mantida constante.
III - em um processo isovolumétrico o volume do gás é mantido constante.
IV - em um processo adiabático a pressão, o volume e a temperatura variam.
A opção correta em relação aos processos acima é:
Considerando as equações termoquímicas fornecidas abaixo, o valor da entalpia padrão de formação de 1 mol do hidróxido de magnésio em kJ vale:
Mg(OH)2 (s) → MgO (s) + H2O (l); ∆H0 = +37,1 kJ
2H2(g) + O2(g) → 2H2O (l); ∆H0 = -571,7 kJ
2Mg(s) + O2(g) → 2MgO (s) ∆H0 = -1203,6 kJ
