Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.539 questões
No que se refere à entropia e ao terceiro princípio da termodinâmica, julgue o item seguinte.
Para um sistema irreversível, a entropia pode ser escrita,
matematicamente, como a quantidade de calor dividida pela
temperatura.
No que se refere à entropia e ao terceiro princípio da termodinâmica, julgue o item seguinte.
Considere que um molde de aço de 40 g, com capacidade
calorífica à pressão constante cp = 0,5 kJ · kg−1
· K−1
,
inicialmente a 450 ºC, tenha sido resfriado em um óleo com
capacidade calorífica à pressão constante
cp = 2,5 kJ · kg−1
· K−1
, inicialmente a 25 ºC. Nessa situação,
a variação de entropia será superior a +16 kJ/K,
considerando-se a ausência de perdas térmicas.
Com relação à espontaneidade e ao segundo princípio da termodinâmica, julgue o item que se segue.
Reações químicas espontâneas têm maior probabilidade de
ocorrência em sistemas isentrópicos.
Com relação à espontaneidade e ao segundo princípio da termodinâmica, julgue o item que se segue.
Em sistemas reais, o balanço de entropia é um fator
importante no cálculo dos trabalhos real e ideal.
Com relação à espontaneidade e ao segundo princípio da termodinâmica, julgue o item que se segue.
Uma reação química com variação de entropia negativa e
variação de entalpia positiva é espontânea.
No que diz respeito a energia e ao primeiro princípio da termodinâmica, julgue o item a seguir.
Um processo será reversível quando seu sentido puder ser
revertido em qualquer ponto do processo por uma variação
infinitesimal das condições externas.
No que diz respeito a energia e ao primeiro princípio da termodinâmica, julgue o item a seguir.
Considerando-se a aceleração da gravidade como igual a
9,8 m/s2
, é correto afirmar que a energia potencial de 1 kg de
água, no topo de uma queda de água de 100 m em relação à
sua base, vale 980 J.
No que diz respeito a energia e ao primeiro princípio da termodinâmica, julgue o item a seguir.
Considere que 2.256,9 kJ de calor tenham sido adicionados a 1 kg de água líquida, vaporizando-a completamente à temperatura constante de 100 ℃ e à pressão constante de 101,33 kPa. Admitindo-se que os volumes específicos da água líquida e do vapor de água sejam, respectivamente, 0,00104 m3 /kg e 1,673 m3 /kg, é correto afirmar que, nas condições apresentadas, as variações de entalpia e de energia valem, respectivamente, menos de 2.090 kJ e mais de 2.250 kJ.
Considere-se uma situação em que é preciso selecionar os equipamentos de proteção individual (EPI) para um trabalhador que vai manusear uma fonte de calibração, eletrodepositada, de 210Po(Eα = 5,30 MeV).
Os EPI ou instrumentos necessários para esse fim são
Considere uma fonte de 137Cs e uma pessoa a um metro de distância, em relação à fonte.
Quando essa pessoa se afasta, aumentando a distância para três metros, qual o fator de redução da sua exposição à radiação?
O radônio (222Rn) é um gás radioativo natural, que se acumula no interior das residências, sendo considerado um dos principais contribuintes para exposição do homem à radiação ionizante.
Considerando-se o seu tempo de meia-vida de 3,82 dias, quanto tempo levaria para uma certa quantidade de 222Rn decair para 70% do seu valor inicial?
No sistema internacional (SI), a unidade de atividade é o Bequerel (Bq). Outra unidade de atividade, o Curie (Ci), é adotada, em particular, nos Estados Unidos.
Quantos Bq equivalem a um micro-Ci?
Na busca pelo equilíbrio nuclear, os nuclídeos podem emitir radiação e se transformar em nuclídeos filhos, formando um novo elemento radioativo. Esse processo continua até que seja formado um isótopo estável.
Na Figura abaixo, mostra-se a série radioativa do Urânio238, gerada por subsequentes desintegrações radioativas. Cada
linha horizontal representa emissão de partícula a, e as linhas verticais são decorrentes de emissões β.
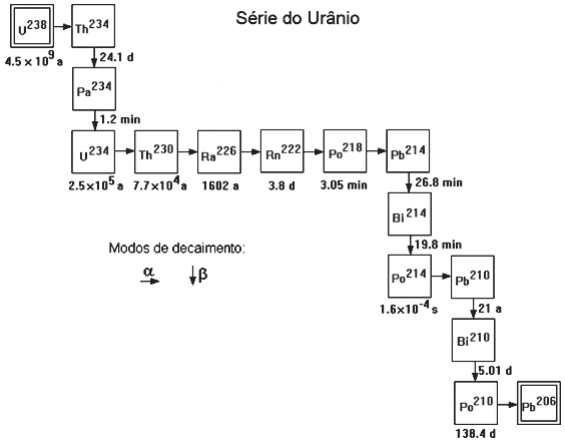
Qual é o elemento radioativo com o menor tempo de meia-vida na série radioativa do U238?
Quando o número de prótons e nêutrons é elevado, o núcleo pode tornar-se instável devido à repulsão elétrica entre os prótons. Essa força pode superar a força nuclear atrativa de curto alcance, resultando na emissão, pelo núcleo, de partículas constituídas de 2 prótons e 2 nêutrons.
Qual é a partícula emitida nesse processo?
Fontes radioativas são amplamente utilizadas em medicina, indústria, ensino e pesquisa científica.
As fontes radioativas encerradas hermeticamente em uma cápsula, ou ligadas totalmente a um material inativo envolvente, de forma que não possa haver dispersão da substância radioativa em condições normais e severas de uso, são classificadas como
O gráfico que melhor representa a variação de entalpia (H) em função da pressão (P) neste processo é:
As armas de fogo são artefatos de dimensões e formas diversas que arremessam um ou mais projéteis utilizando a força de expansão de gases resultantes da combustão da pólvora. Atualmente se utilizam pólvoras baseadas em nitrocelulose e nitroglicerina, mas antigamente as armas de fogo usavam a pólvora preta, cuja combustão é representada pela equação a seguir, que está desbalanceada:
S(sol.) + C(sol.) + KNO3 (sol.) → CO2 (g) + N2 (g) + K2S (sol)
A equação equilibrada estequiometricamente é
Suponha que em um cilindro provido de um pistão móvel sem atrito seja realizada a combustão completa de determinada quantidade de etanol líquido, conforme equação química a seguir, em um processo isotérmico e isobárico em que os gases presentes se comportam idealmente e o volume da fase líquida é constante.
C2H5OH (l) + 3 O2 (g) → 2 CO2 (g) + 3 H2O (l)
Do ponto de vista termodinâmico, nesse processo, o(a)
Considere as equações químicas a seguir.
I NH3 + H2O ⇌ NH4+ + OH−
II Cu2+ + 4 NH3 ⇌ [Cu(NH3)4] 2+
III 2 Fe3+ + Sn2+ ⇌ 2 Fe2+ + Sn4+
Ocorre reação de oxirredução apenas na(s) equação(ões)