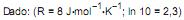Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.458 questões
seguem.
seguem.
seguem.
seguem.
seguem.
da corrosão e dos materiais de construção de equipamentos
industriais, julgue os itens a seguir.

Com referência à célula galvânica descrita, considerando que as soluções envolvidas apresentam comportamentos ideais e que log 5 = 0,7 e log 2 = 0,3, julgue os itens seguintes.

Com referência à célula galvânica descrita, considerando que as soluções envolvidas apresentam comportamentos ideais e que log 5 = 0,7 e log 2 = 0,3, julgue os itens seguintes.
 não varia no intervalo de temperaturas entre 373 K e 400 K.
não varia no intervalo de temperaturas entre 373 K e 400 K.Com referência à situação hipotética descrita acima, julgue os itens.

As associações corretas são

Com base nessas informações, julgue os itens que se seguem.
Caso, na reação acima, a coloração amarela torne-se mais intensa ao se aumentar a temperatura do sistema, é correto concluir que a reação será endotérmica no sentido da formação de
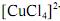 .
. 
Considerando as informações acima e que todos os gases envolvidos sejam ideais, julgue os itens a seguir.
Na equação abaixo, se expressa, corretamente, a quantidade de calor (q) necessária para elevar, a pressão constante, a temperatura de um mol de
 de 298 K até uma temperatura
de 298 K até uma temperatura

Considerando as informações acima e que todos os gases envolvidos sejam ideais, julgue os itens a seguir.
A capacidade calorífica molar, a volume constante, do
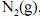
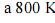 , é maior que
, é maior que 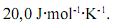 .
. 


A geometria planar da molécula de amônia é responsável pelo seu elevado calor de vaporização.

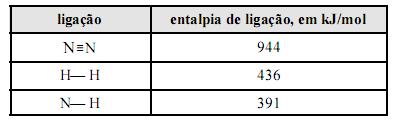
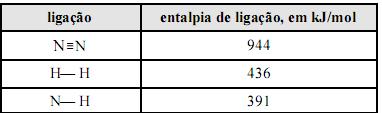
Considere que a amônia (NH3), largamente empregada como gás refrigerante, em razão de seu elevado calor de vaporização, pode ser obtida a partir da reação 3H2(g) + N2(g) 2NH3(g). Considere, ainda, a tabela acima, em que constam as entalpias de ligação, a 25 ºC, das ligações rompidas ou formadas durante a reação em questão. Com base no conjunto de informações apresentado, julgue os itens que se seguem.
A reação de formação da amônia, a partir de H2(g) e N2(g), libera mais calor quando processada a volume constante, comparando-se quando processada a pressão constante.
água. Essa substância é também a mais abundante no organismo
humano. Sendo a água tão comum, tem-se a tendência de considerar
triviais suas propriedades químicas e físicas. Entretanto, ela possui
muitas propriedades não usuais e essenciais à vida na Terra. Uma
das propriedades mais importantes da água é a sua capacidade de
dissolver uma grande variedade de substâncias. Por essa razão, a
água é encontrada na natureza com um vasto número de substâncias
nela dissolvidas. Como exemplo dessas substâncias, podem-se citar
materiais radioativos, matérias orgânicas, coloides e metais
pesados, entre outros.
Tendo o texto acima como referência inicial, julgue os itens a
seguir, a respeito de aspectos diversos de química.

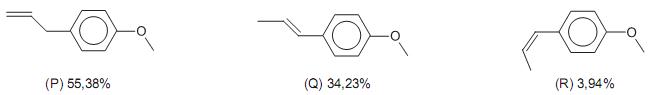
Disponível em: http://teses.icict.? ocruz.br/pdf/paulajfpm.pdf
Acesso em: 08 out. 2010. (Adaptado)
Em relação a algumas reações que podem ser realizadas com o estragol, transanetol e cisanetol, analise as afirmativas a seguir.
I - Os produtos principais da reação de hidrogenação de (P) e (Q), catalisada por platina a 25 °C e a pressão de 1 atm, são isômeros constitucionais.
II - Tanto (Q) como (R) podem descorar uma solução de
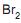 em tetracloreto de carbono com a formação de um mesmo produto principal de reação.
em tetracloreto de carbono com a formação de um mesmo produto principal de reação. III - A reação de (P) com HBr pode levar a formação de um produto de reação idêntico ao obtido na reação de (Q) com HBr.
IV - O calor liberado na reação de hidrogenação da dupla olefínica de (Q) é menor do que na de (R).
Estão corretas APENAS as afirmações
PORQUE
O eletrodo Ag/AgCl tem um potencial conhecido, que é essencialmente constante e insensível à composição das soluções de estudo, sendo, ainda, construído com base em uma reação reversível; obedece à Equação de Nerst, pode retornar ao seu potencial original após ser submetido a pequenas correntes e exibe baixa histerese sob ciclos de temperatura.
A esse respeito, conclui-se que
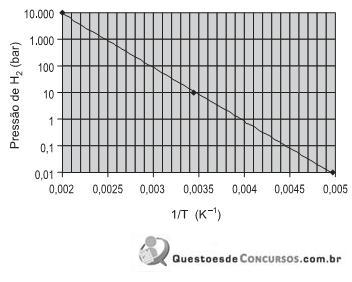
O armazenamento de hidrogênio em volumes reduzidos pode ser conseguido por meio da formação de hidretos metálicos. O gráfico de Van’t Hoff apresentado acima exibe a pressão de equilíbrio de hidrogênio, em função da temperatura para a seguinte reação:
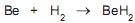
Qual a variação de entalpia, em kJ, estimada para essa reação?