Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.539 questões
Zn(s)+ Cu2 (0,020M) + Cu(s) + Zn2+ (0,40M)
Sabendo-se que Eº = 1,10 e log 20 = 1,30, a f.e.m. da pilha Zn/Cu é:


Definindo-se a dependência: h = h(s,p), a seguinte expressão é obtida:

O balanço de massa global na coluna e os valores das
entalpias específicas das correntes da envoltória global
são dados na tabela a seguir.

A carga térmica removida pela água de resfriamento no
condensador é de 4,2 GJ/h.
E° Ag+1 /Ago = + 0,80 V
E° Cu+2 /Cuo = + 0,34 V
Sobre a pilha, conclui-se que ela funciona de maneira espontânea e que

Trata-se de uma reação de oxirredução, e nela
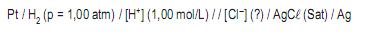
Para diferença de potencial de + 340 mV, determinada em um milivoltímetro eletrônico, a concentração aproximada de cloreto, na amostra de água, em mol/L, é

I – O gás hidrogênio é borbulhado continuamente sobre a superfície do eletrodo a uma pressão de 1,00 atm.
II – O potencial de redução do eletrodo padrão de hidrogênio, atribuído por convenção, é zero em qualquer temperatura.
III – O metal condutor (Pt) é reduzido pelo hidrogênio atômico, formando um depósito de platina finamente dividida (negro de platina).
IV – A reação do eletrodo de hidrogênio é irreversível, ocorrendo sempre no sentido da redução.
Estão corretas APENAS as afirmativas
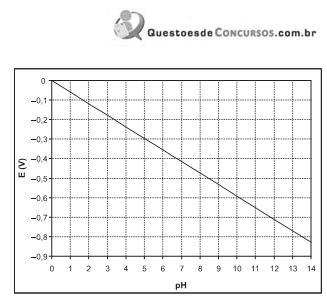
Sobre a transformação da água em gás hidrogênio, por um processo de oxidação/redução, considere as afirmativas abaixo.
I – O uso de qualquer agente oxidante provoca a liberação do gás hidrogênio, independente do valor do pH da solução.
II – Para pH igual a seis, a liberação de gás hidrogênio só será observada se o outro reagente apresentar potencial do eletrodo menor que, aproximadamente, – 0,35 V.
III – A liberação de gás hidrogênio em meio fortemente ácido só será observada se a espécie que irá reagir apresentar potencial do eletrodo positivo.
IV – Existem metais capazes de provocar a liberação de gás hidrogênio, mesmo com o valor de pH igual a 14.
Estão corretas APENAS as afirmativas
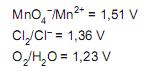
Nas condições padrão, haverá formação de gás pela reação entre
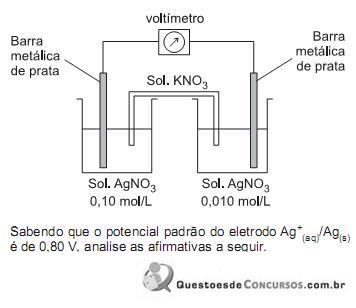
I – A força eletromotriz da pilha registrada pelo voltímetro terá um valor de 1,60 V no início do processo.
II – As concentrações de íons de prata nas duas soluções serão iguais quando o equilíbrio for atingido.
III – O catodo dessa pilha é formado pela barra metálica de prata e a solução de concentração de 0,10 mol/L.
IV – A massa da barra metálica de prata mergulhada na solução de concentração 0,010 mol/L diminuirá até o equilíbrio ser atingido.
Estão corretas APENAS as afirmativas
A corrosão é um fenômeno químico que resulta da ação do meio sobre um determinado material, podendo ser por ação química ou eletroquímica. Não só os materiais metálicos sofrem corrosão. Polímeros como o poli(tereftalato de etileno) (PET) e o concreto também sofrem processos corrosivos. A corrosão dos materiais, os acidentes de transporte e os erros operacionais provocam sérios prejuízos ambientais devido ao vazamento de oleodutos, de tanques de combustíveis, entre outros.

Com relação à corrosão citada, analise as afirmativas a seguir
I - A água sofre redução, enquanto o ferro sofre oxidação.
II - A reação catódica é

III - A diferença de potencial elétrico padrão do processo de corrosão é +0,04 V.
IV - O oxigênio atua como agente redutor.
Está correto APENAS o que se afirma em
A corrosão é um fenômeno químico que resulta da ação do meio sobre um determinado material, podendo ser por ação química ou eletroquímica. Não só os materiais metálicos sofrem corrosão. Polímeros como o poli(tereftalato de etileno) (PET) e o concreto também sofrem processos corrosivos. A corrosão dos materiais, os acidentes de transporte e os erros operacionais provocam sérios prejuízos ambientais devido ao vazamento de oleodutos, de tanques de combustíveis, entre outros.

Peças de metal que são enterradas no solo sofrem corrosão eletroquímica com frequência. Alguns exemplos são os oleodutos, gasodutos, tanques de gasolina, entre outros. Graças à proteção catódica, tubulações de aço ficam protegidas da corrosão, utilizando-se, por exemplo, anodos de sacrifício. Conhecendo-se os potenciais padrões de redução de alguns metais (X, Y, Z e W), acima apresentados, quais deles poderiam ser utilizados para evitar a corrosão dessas tubulações?
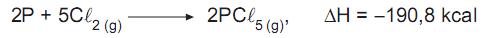
A equação termoquímica acima representa a reação de formação do elemento
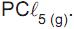 Qual o calor de formação desse elemento?
Qual o calor de formação desse elemento?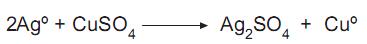
Na reação química acima, a prata reage com sulfato de cobre, obtendo sulfato de prata e cobre puro. Qual o agente oxidante nessa reação?
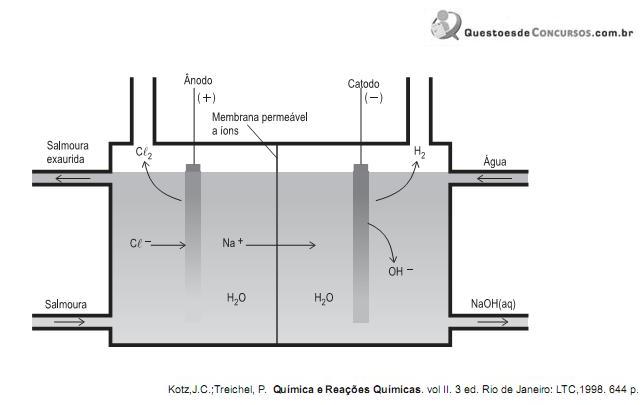
Com base nos conhecimentos sobre a eletrólise da salmoura, conclui-se que
