Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.458 questões
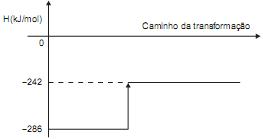
Sobre essa transformação, considere as afirmativas a seguir.
I – A conversão da H2O (l) em H2O (g) é um processo exotérmico.
II – A entalpia de vaporização da água é de +44kJ/mol.
III – A entalpia molar padrão de formação para H2O (l) é de –242kJ/mol.
IV– A entalpia molar padrão de formação para H2O (g) é de –286kJ/mol.
Está(ao) correta(s) a(s) afirmativa(s)
H2CrO4 + NaHSO3 + H2SO4 ? Cr2(SO4)3 + Na2SO4 + H2O
A soma dos coeficientes mínimos desta equação é:
5927Co + 10n ?6027Co*(instável) ? 6027Co + radiação
Com base na informação acima, é INCORRETO afirmar que:


 (g) = 1,0 bar –, tendo como eletrólito uma solução de ácido clorídrico 0,010 mol L-1 , e outro eletrodo composto por uma bastão de prata mergulhado em solução de nitrato de prata 0,10 mol L-1 .
(g) = 1,0 bar –, tendo como eletrólito uma solução de ácido clorídrico 0,010 mol L-1 , e outro eletrodo composto por uma bastão de prata mergulhado em solução de nitrato de prata 0,10 mol L-1 .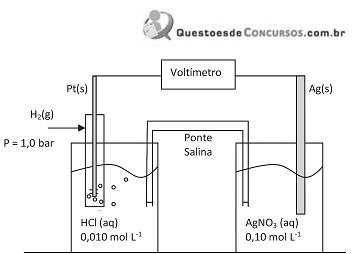
Sendo dados os potenciais padrão de redução
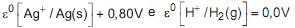 e, considerando-se uma temperatura de 25 °C, a força eletromotriz registrada no voltímetro no início do processo será de
e, considerando-se uma temperatura de 25 °C, a força eletromotriz registrada no voltímetro no início do processo será de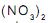 de concentração igual a 1,0 mol.L-1 e deixadas em repouso por algumas horas. Sendo dados os potenciais padrão de redução:
de concentração igual a 1,0 mol.L-1 e deixadas em repouso por algumas horas. Sendo dados os potenciais padrão de redução: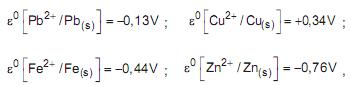
será observada oxidação APENAS na(s) placa(s) de
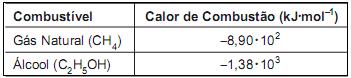
O volume, em litros, de gás natural, medido nas CNTP, que precisa ser queimado para produzir a mesma quantidade de calor que resulta da combustão de 1,0 mol de etanol é igual a
NH4 NO3 (s) -> N2O(g) + 2H2O(g)
As entalpias padrão de formação dos compostos NH4NO3 (s), N2O(g) e H2O(g) são iguais a -365,3 kJmol –1 , +81,6 kJmol –1 e -241,8 kJmol –1 , respectivamente. Sendo ΔH0 , ΔS0 e Δ?G0 , respectivamente, as variações de entalpia, entropia e energia livre padrão para a reação, a decomposição do nitrato de amônio em óxido de dinitrogênio e água apresenta
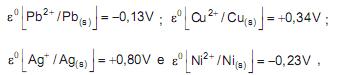
ocorrerá oxidação da lâmina de cobre APENAS na(s) solução(ões) de
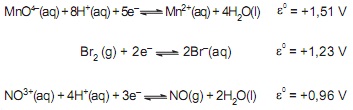
As seguintes afirmações são apresentadas:
I – haverá reação espontânea quando NO(g) for borbulhado em solução aquosa ácida (pH = 0) de KMnO4 1,0 mol L–1 ;
II – haverá reação espontânea quando Br2 (g) for borbulhado em solução aquosa ácida (pH = 0) de KMnO4 1,0 mol L–1 ;
III – o bromo apresenta poder oxidante maior que o de uma solução de ácido nítrico 1,0 mol L–1 ;
IV – uma solução de ácido nítrico 1,0 mol L–1 apresenta poder oxidante maior que o de uma solução aquosa ácida (pH = 0) de KMnO4 1,0 mol L–1 .
Estão corretas APENAS as afirmativas
CO2(g) + H2(g) -> CO(g) + H2O(g) -> ΔH0 = +41,2 KJ.mol –1
Sabendo-se que os calores de formação padrão para H2O(g) e Fe2O3 (s) são iguais a -241,8 kJ×mol –1 e -824,8 kJ x mol –1 , respectivamente, a variação de entalpia no estado padrão para a reação
Fe2O3 (s) + 3CO(g) -> 2Fe(s) + 3CO2 (g)
será igual a
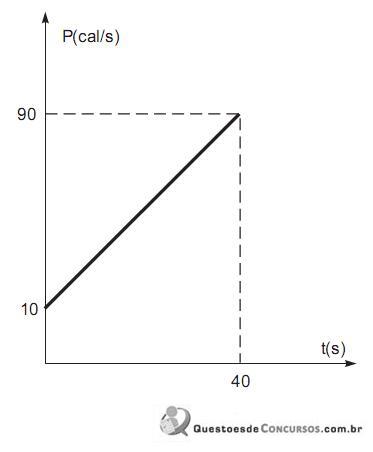
Sabe-se que, durante o intervalo de tempo representado no gráfico, todo o calor produzido pela fonte térmica é utilizado no aquecimento do bloco. Com base nessas informações, o calor específico da substância que constitui o referido corpo, em cal/g. o C, vale
I – A quantidade de prata depositada na terceira cuba é 4,59 g.
II – Há produção de gás oxigênio apenas na segunda cuba.
III – A quantidade de ácido sulfúrico permanece constante na segunda cuba.
IV – O volume de oxigênio produzido, nas CNTP, na segunda cuba, é de 0,24 L.
Dado: Volume molar dos gases na CNTP = 22,4 L.mol –1
Estão corretas APENAS as afirmativas
hidrogênio. Quando ele se sente ameaçado, essas substâncias se misturam e, através de uma catálise enzimática, há a formação de p-benzoquinona, que é expelida sob a
forma de uma solução quente, de acordo com a reação abaixo.
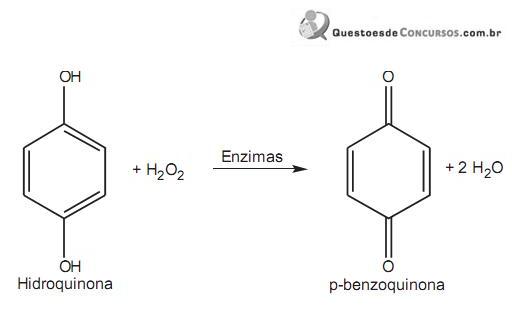
Nessa reação de oxirredução,
• solução de tiossulfato de sódio;
• dióxido de manganês;
• carbonato de cálcio;
• zinco metálico.
Sobre essas reações, analise as afirmativas a seguir.
I - O ácido clorídrico atua como agente oxidante do tiossulfato na reação Na2S2O3(aq)+2 HCl(aq) → 2 NaCl(aq)+ SO2(g)+H2O(l)+S(s)
II - O dióxido de manganês atua como agente oxidante do cloreto na reação MnO2(s) + 4 HCl(aq) → MnCl2(aq) +Cl2(g) + 2 H2O(l)
III – O carbonato de cálcio é oxidado pelo ácido clorídrico na reação CaCO3 (s) + 2 HCl(aq) → CaCl2 (aq) +CO2(g) + H2O(l)
IV – O zinco metálico é oxidado pelo ácido clorídrico na reação Zn(s) + 2 HCl(aq) → ZnCl2(aq) + H2(g)
Estão corretas APENAS as afirmativas
Cu(s) | Cu2+(aq, 1,0 mol/L) || Cl -1 (aq, 1,0 mol/L) | Cl2(g, 1,0 atm) | Pt(s)
Dados os potenciais padrões de redução:
ε0[Cu2+(aq)/Cu(s)] = +0,34V
ε0[Cl2(g)/Cl - (aq)] = +1,36V
No processo eletroquímico em questão, a(o)
I – Haverá formação de gás no polo negativo (catodo).
II – O pH da solução tende a diminuir em função da formação de íons H+ no anodo.
III – A concentração de íons I - tende a diminuir na solução.
IV – A concentração de íons Na+ tende a diminuir na solução.
Dados: ε0[Na+(aq)/Na(s)] = −2,71V
ε0[H2O(l)/H2(g),OH−(aq)] = −0,83V
ε0[I2(g)/I−(aq)] = +0,54 V
ε0[O2(g), H+(aq)/H2O(l)] = +1,23V
Estão corretas APENAS as afirmativas
