Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.539 questões
H2 O2 (aq) → H2 O(L) + ½ O2 (g),
é uma reação de oxirredução na qual o elemento
A corrosão química somente ocorre em meio aquoso, uma vez que há transferência de elétrons no meio.
A corrosão eletroquímica é um processo espontâneo no qual acontecem, simultaneamente, reações anódicas e catódicas.
A corrosão química ocorre apenas em metais.
A corrosão eletrolítica caracteriza-se por um processo eletroquímico, porém não espontâneo, uma vez que ocorre, com frequência, em tubulações de petróleo e em tanques de postos de gasolina, por meio da aplicação de uma corrente elétrica externa.
Considere os tipos de convecção abaixo.
CFG - convecção forçada de gases
CFL - convecção forçada de líquidos
CNG - convecção natural de gases
CNL - convecção natural de líquidos
Sabe-se que, para cada tipo de convecção apresentada, o coeficiente de transferência de calor possui um limite superior diferente.
Usando os valores desses limites superiores para ordenar, em ordem crescente, os tipos de convecção, tem-se
Uma barra de comprimento inicial L0, após aquecida, apresenta um comprimento L, maior que seu comprimento inicial.
A dilatação da barra é tanto maior quanto
A escala de temperatura Fahrenheit define as temperaturas do ponto de gelo e do ponto de vapor, respectivamente, como
Dois tratamentos térmicos aplicáveis somente em aços transformáveis, ou seja, quando se envolve transformação de fase a partir da austenita, são a(o)
O potencial de oxidação do ferro é mais alto do que o potencial de oxidação do
Uma expedição de pesquisa chega a um local ermo. Os pesquisadores descobrem que levaram o termômetro errado para medir a temperatura ambiente. Ele havia sido graduado em uma escala X que, em água fervente a 1 atm, indica 80 °X e que, em gelo fundente a 1 atm, indica 30 °X.
Qual a temperatura em °C que esse termômetro mede quando indica 40 °X?Quando se dissolve cloreto de amônio (NH4Cl) em água, a temperatura da solução formada diminui, pois a dissociação desse sal é um processo endotérmico. A variação de entalpia (calor de reação à pressão constante) na dissolução de 1 mol de NH4Cl é igual a 15 kJ.
Se a preparação de uma solução aquosa desse sal produziu 3 kJ, medidos em um calorímetro, a massa, em gramas, dissolvida foi
Dado:
MMcloreto de amônio= 53,5 g/mol
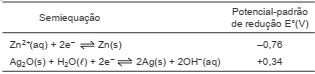
A pilha de zinco e óxido de prata é usada em aparelhos auditivos e relógios de pulso e são menos poluentes do que a de zinco e óxido de mercúrio.
Tendo em vista essas informações e os dados da tabela de
potencial-padrão de redução para as semiequações que
ocorrem nessa pilha, é correto afirmar:
Cr2O2-7 (aq) + Cℓ− (aq) + H+ (aq) → Cr3+(aq) + H2O(ℓ) + Cℓ2(g)
No balanceamento de equações de oxirredução, algumas espécies transferem elétrons para outras, de forma que, no final da reação química, o número de elétrons transferidos é igual ao de elétrons recebidos.
Com base nessas informações e após o balanceamento da equação química com os menores coeficientes estequiométricos inteiros, é correto afirmar:
I. 2H+(aq) + 1/2O2(aq) + 2e- → H2O(ℓ) Eºred = + 1,23v
II. Fe3+(aq) + e- → Fe2+(aq) Eºred = +0,77
As soluções aquosas ácidas de sais de íons Fe2+(aq) são esverdeadas quando recém-preparadas e, quando em contato prolongado com o ar, tornam-se amareladas.
A partir dessas considerações e das semiequações I e II
com os respectivos potenciais-padrão de redução, é correto
afirmar:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) ΔHo = − 890kJ
A energia elétrica proveniente de biomassa é uma alternativa amplamente utilizada por grandes empresas do agronegócio nas regiões sul e sudoeste. A energia produzida não somente atende às necessidades dos empreendimentos, como também é vendida a concessionárias na região. A fermentação de restos de vegetais e de dejetos de animais coletados nas fazendas de pecuária e de suinocultura é processada em biodigestores e produz biogás, uma mistura gasosa de metano, CH4(g), sulfeto de hidrogênio, H2S(g) e dióxido de carbono, CO2(g), dentre outros gases, e resíduos ricos em bionutrientes usados como fertilizantes na propriedade rural. A combustão do metano, mostrada pela equação química, libera calor utilizado na geração de energia elétrica.
De acordo com essas informações sobre o processo de
geração de energia a partir de biomassa, e
considerando-se o calor específico da água 4,2Jg−1
K−1
, é
correto afirmar:

