Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.539 questões

A partícula denominada quark é uma das partículas fundamentais do Universo (a outra é o lépton, constituinte dos elétrons). Os quarks se caracterizam por estarem no núcleo atômico, mais precisamente nos prótons e nos nêutrons, uma vez que os prótons e os nêutrons são nada mais que uniões de quarks de determinadas cargas e massas.
O carbono radioativo ( 6 C14 ) utilizado pelos cientistas em seus experimentos de “rastreamento" é um isótopo do carbono comum ( 6 C12 ), isto é, apresenta mesmo número atômico (Z) e diferentes números de massa (A). O carbono radioativo apresenta a seguinte constituição:
Abaixo está representada a reação de combustão do metanol:
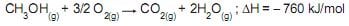
Na combustão completa de 1,0 L de metanol, no estado gasoso, a quantidade de energia liberada, em kJ, é, aproximadamente, igual a
Um exemplo de reação de oxirredução é
De forma geral, o fluxo de energia ocorre do maior potencial para o menor potencial; consequentemente, um corpo quente ende a esfriar-se ao ser posto em um ambiente mais frio que ele.
A energia nuclear refere-se às transformações que acontecem nos núcleos dos átomos, os quais, devido à forte repulsão entre os prótons (com cargas positivas) presentes no núcleo, possuem energia de ativação menor que a obtida nas transformações químicas que ocorrem no dia a dia.
CH4 (g) + 2 O2 (g) → CO2 (g) + 2H2 O(l); ΔH= -890,4 kJ
Com base na informação representada, constata-se que o(a)
Basicamente, uma pilha eletroquímica tem os componentes mencionados a seguir, que apresentam as seguintes características:
A pilha de Daniell é representada pelo seguinte diagrama de célula:

Na pilha de Daniell, o zinco oxida no cátodo, polo positivo da pilha.
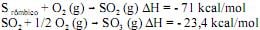
Considerando essas equações químicas, julgue os itens seguintes.
As reações de formação dos óxidos de enxofre são endotérmicas.
O carbono constitui toda matéria orgânica, havendo, nos seres vivos, uma razão entre a quantidade de carbono-14 — isótopo radioativo — e de carbono-12, de modo que, quando o organismo morre, a relação entre carbono-14 e carbono-12 decresce.
Sabendo-se que o urânio-238 tem período de meia-vida de 8.766 horas, é correto afirmar que sua vida média é de aproximadamente 1,27.104 horas
O urânio é um dos elementos radioativos utilizados nas usinas nucleares e na fabricação das bombas atômicas. A fissão nuclear do urânio é representada pela seguinte equação: 92U235 + 0n1 → 56Ba138 + 36Kr86 +10 0n1 .
A radiação γ apresenta elevado poder de penetração na pele, podendo, por isso, causar danos celulares
A descoberta do nêutron, por Chadwick, tornou-se possível com a seguinte reação de transmutação: x + 4Be9 → 6C12 + 0 n1 em que x representa uma partícula β
Após a descoberta da radioatividade, foi possível identificar novos elementos da tabela periódica. O urânio, de número atômico 92, que era o elemento mais pesado na tabela, passou a ser seguido por outros elementos, denominados transurânicos.
(Disponível em: http://oglobo.globo.com/ciencia/eua-voltam-produzir-plutonio-para- alimentar-sondas-espaciais-7881294. Acesso em março de 2013.)
Este radionuclídeo pode ser sintetizado pelo bombardeio de núcleos de urânio-238 com deutério, produzindo netúnio-238. O netúnio-238 sofre um decaimento produzindo o plutônio-238, esse decaimento ocorre com a emissão de partícula:
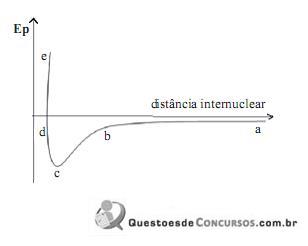
O ponto da curva relacionado com o comprimento da ligação química está representado pela letra:
CCl3 CHCl2 (g) + 2 HF(g) → CCl 3 CHF2 (g) + 2 HCl(g)
Utilizando as energias de ligação médias:
Ligação Energia de Ligação (kJ.mol–1)
C–Cl 338
C–F 484
H–F 565
H–Cl 431
A variação de entalpia da reação apresentada, em kJ.mol–1 , é igual a: