Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.539 questões
Nessas condições, a massa em gramas do cobre depositado no catodo é
Os íons de maior e de menor prioridade de descarga são, respectivamente,
http://portodecabedelo.blogspot.com.br/2012/09/oxidacao-dos- -casco-dos-navios.html
São dadas as semirreações de redução:
Fe2+ + 2e- → Fe(s)
O2 + 2H2O + 4e- → 4OH-
A reação que descreve o fenômeno da oxirredução das estruturas é
( ) As pilhas que não podem ser recarregadas são classificadas como sistemas eletroquímicos primários ou baterias primárias.
( ) O destino ideal de pilhas e baterias usadas deveria ser o aterro controlado, pois todo o lixo recebe uma cobertura de PVC ou argila, o que evita contaminação do ambiente.
( ) As baterias de níquel/cádmio são baterias secundárias e de longa duração.
( ) Na pilha alcalina não há formação de gás hidrogênio, pois o meio é básico.
( ) Nas pilhas de mercúrio, usadas em relógios e calculadoras, o mercúrio é oxidado a óxido de mercúrio, que é solúvel e pode contaminar o solo se descartada incorretamente.
Assinale a opção que contenha a sequência CORRETA de cima para baixo.
Cl2 + 2NaOH ? NaCl + H2O + NaClO
O outro método de produção é a eletrólise de uma solução concentrada de cloreto de sódio, com o que se obtêm o mesmo produto.
Sobre esse segundo método de produção do hipoclorito de sódio, assinale a alternativa CORRETA.
Na figura I, a seguir, apresenta-se um esquema da montagem usada na titulação de 50,0 mL de uma solução problema de Fe 2+ , em meio ácido, com uma solução de Ce 4+ 0,100 mol/L. O eletrodo de referência empregado é um eletrodo de calomelano cujo potencial elétrico é 0,24 V. Na figura II, apresenta-se a curva de potencial obtida. A tabela apresenta os potenciais elétricos padrão das semirreações envolvidas na reação global (Fe 2++ Ce4+→ Fe 3+ + Ce 3+ ), assim como o potencial do eletrodo padrão de hidrogênio.

Na reação de oxirredução apresentada, o Fe2+ é o agente redutor, e o Ce 4+ , o agente oxidante
Na figura I, a seguir, apresenta-se um esquema da montagem usada na titulação de 50,0 mL de uma solução problema de Fe 2+ , em meio ácido, com uma solução de Ce 4+ 0,100 mol/L. O eletrodo de referência empregado é um eletrodo de calomelano cujo potencial elétrico é 0,24 V. Na figura II, apresenta-se a curva de potencial obtida. A tabela apresenta os potenciais elétricos padrão das semirreações envolvidas na reação global (Fe 2++ Ce4+→ Fe 3+ + Ce 3+ ), assim como o potencial do eletrodo padrão de hidrogênio.

Em uma célula galvânica constituída por um eletrodo de calomelano e um eletrodo padrão de hidrogênio, os elétrons fluirão do eletrodo de hidrogênio para o eletrodo de calomelano.
Na figura I, a seguir, apresenta-se um esquema da montagem usada na titulação de 50,0 mL de uma solução problema de Fe 2+ , em meio ácido, com uma solução de Ce 4+ 0,100 mol/L. O eletrodo de referência empregado é um eletrodo de calomelano cujo potencial elétrico é 0,24 V. Na figura II, apresenta-se a curva de potencial obtida. A tabela apresenta os potenciais elétricos padrão das semirreações envolvidas na reação global (Fe 2++ Ce4+→ Fe 3+ + Ce 3+ ), assim como o potencial do eletrodo padrão de hidrogênio.

Considere que tenha sido adicionado um volume da solução de Ce 4+ correspondente à metade do volume necessário para se atingir o ponto de equivalência. Nesse caso, o módulo do potencial elétrico lido no potenciômetro representado na figura I será superior a 0,70 V.
Na figura I, a seguir, apresenta-se um esquema da montagem usada na titulação de 50,0 mL de uma solução problema de Fe 2+ , em meio ácido, com uma solução de Ce 4+ 0,100 mol/L. O eletrodo de referência empregado é um eletrodo de calomelano cujo potencial elétrico é 0,24 V. Na figura II, apresenta-se a curva de potencial obtida. A tabela apresenta os potenciais elétricos padrão das semirreações envolvidas na reação global (Fe 2++ Ce4+→ Fe 3+ + Ce 3+ ), assim como o potencial do eletrodo padrão de hidrogênio.

A concentração de ferro na solução problema é superior a 0,090 mol/L
Na figura I, a seguir, apresenta-se um esquema da montagem usada na titulação de 50,0 mL de uma solução problema de Fe 2+ , em meio ácido, com uma solução de Ce 4+ 0,100 mol/L. O eletrodo de referência empregado é um eletrodo de calomelano cujo potencial elétrico é 0,24 V. Na figura II, apresenta-se a curva de potencial obtida. A tabela apresenta os potenciais elétricos padrão das semirreações envolvidas na reação global (Fe 2++ Ce4+→ Fe 3+ + Ce 3+ ), assim como o potencial do eletrodo padrão de hidrogênio.

O potencial elétrico padrão para a reação global de oxirredução apresentada é superior a 2,0 V.
2H2O2(aq) → 2H2O(l) + O2(g)
Por ser considerada uma reação lenta em condições normais, os estudantes utilizaram, como catalisador, o cloreto férrico. O estudo foi conduzido de maneira que a concentração remanescente de H2O2 fosse determinada, de tempo em tempo, durante a reação, por meio da titulação de oxirredução de alíquotas de 5,0 mL da mistura reacional com permanganato de potássio em meio ácido. A reação não balanceada envolvida na titulação é dada pela equação:
MnO4 - ( aq) + H2O2(aq ) + H +( aq) Mn 2+ ( aq) + H2O( l ) + O2(g).
Após os resultados, os estudantes plotaram o logaritmo natural da concentração da água oxigenada remanescente em função do tempo, obtendo o seguinte gráfico:

A equação da reação de oxirredução da água oxigenada com permanganato de potássio em meio ácido mostrada a seguir está corretamente balanceada.
MnO4 - ( aq) + H2O2 (aq) + 2H+(aq ) → Mn 2+ ( aq) + 2H2O( l ) + 2O2(g).
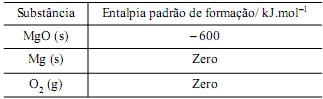
Com base nesses dados, podese afirmar que a combustão completa de 4,86 g de magnésio metálico
As lacunas desse texto são, correta e respectivamente, preenchidas por:
A energia necessária para levar o gelo até a temperatura de fusão e a energia necessária para fundir o gelo, são, em J, respectivamente,
Considere
cgelo = 2,2 J/g K
LF =330 J/g
I - É função do revestimento impedir a mistura do material da alma metálica com o metal de solda.
II - É função do revestimento a remoção dos elementos de liga do metal de solda.
III - É função do revestimento o isolamento mecânico da alma metálica.
É correto APENAS o que se afirma em
Qual é, em J, a energia retirada para congelar os 100 g de água?
Dados
Lfusão = 336 J/g
cágua = 4,2 J/g.° C
Na reação de oxirredução representada pela equação não balanceada acima, o número de oxidação médio do.