Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.423 questões
I - o sinal da variação de entalpia não depende do sentido da reação termoquímica.
II - a variação de entalpia de uma reação depende somente da entalpia inicial dos reagentes.
III- uma equação termoquímica pode ser expressa pela soma das etapas intermediárias.
Dos itens acima, apenas:
Bi2 O3 + NaClO + NaOH → Na BiO3 + NaCl + H2O
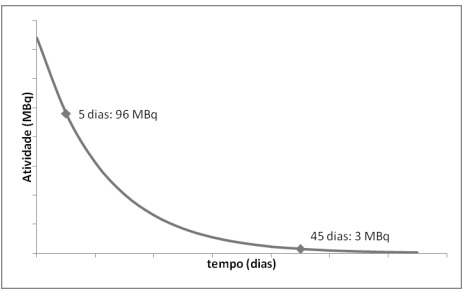
A partir do gráfico, pode-se concluir que a meia-vida do 131 I é, em dias, aproximadamente:
A entalpia de formação do CS 2(l) a partir de seus elementos formadores tem ΔH = _____________ sendo, portanto uma reação _______________. Assinale a alternativa que contém os complementos corretos para a frase acima, respectivamente.
Dados:
Capacidade calorífica da água: 1 cal.g-1 . o C-1 .
Capacidade calorífica da solução neutralizada:1 cal.g-1 . o C-1 .
Densidade da água e de todas as soluções envolvidas: 1g.mL-1 .
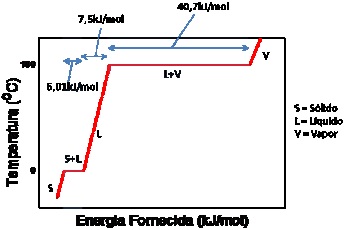
Figura 1 – Questão 12: Curva de aquecimento da água pura. (Adaptado). Fonte: Atkins, P. Jones, L. Chemistry, Molecules, Matter and Change. 4th ed. W. H. Freeman and Company. New York, 1999.
O mínimo de energia necessário para passar 1g de água do estado sólido para o estado vapor é: Dados: H= 1 g mol -1; O = 16 g mol -1
I3- + 2e- ⇌ 3 I -
Considerando as informações fornecidas acima, qual a quantidade de matéria de I3 - consumida após a passagem de 0,193 A durante 500 s ?
Dado: Constante de Faraday = 96500 C mol -1
Ag | AgBr(s)| Br – (c=0,10) || Cl – (c=0,01) | AgCl(s)| Ag
Qual o potencial fornecido pela célula representada acima?
Dados:
AgBr(s) + 1e- → Ag(s)+ Br – E0 = +0,0713V
AgCl(s) + 1e- → Ag(s)+ Cl – E0 = +0,22V
a 25o C: 2,303 RT/F = 59mV
Dados: 1 mol de elétrons = 96500 C (1 F), massa molar do Al = 27g.mol -1
Dados: Massas molares (g.mol -1 ), H= 1, C=12, O=16
Dados:
Zn 2+(aq) + 2è → Zn(s) E0 = - 0,76V
2H+(aq) + 2è → H 2(g)E0 = 0,00V
I. H2O(l) → H2(g) + ½ O2 (g) ΔH = +286 kJ
II. H2(g) + ½ O2 (g) → H2O(v) ΔH = –242 kJ
Assinale, a seguir, o ΔH da passagem de H2O → H2O(l).
I. O oxigênio pode comportar-se como acelerador do processo eletroquímico de corrosão.
II. A corrosão eletroquímica será tanto mais intensa quanto maior o valor de pH.
III. Na corrosão eletroquímica, o metal se oxida num lugar, o oxidante se reduz em outro e o produto de corrosão se forma em regiões intermediárias, não apresentando características protetoras.
Está(ão) correta(s) a(s) afirmativa(s)