Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.458 questões
Na proteção com metal de sacrifício, o material a ser protegido é conectado como ânodo de uma célula galvânica, sendo o cátodo um metal mais ativo que se consome à medida que protege o material.
Há casos benéficos de corrosão, como a oxidação de aços inoxidáveis, que produz uma camada protetora de óxido de cromo, e a proteção do material de alumínio, com a formação de óxido de alumínio.
Considerando os potenciais de oxidação mostrados a seguir, é correto afirmar que a limpeza de aço inoxidável com cloro pode ser recomendada por impedir a corrosão devido ao menor potencial de oxidação (E) do ferro (Fe) em relação ao cloro
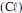 .
.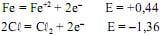
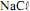 operando com uma corrente constante de 100,0 A e com rendimento de 100% para a formação de
operando com uma corrente constante de 100,0 A e com rendimento de 100% para a formação de 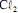 . Considerando que a massa molar do
. Considerando que a massa molar do 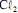 seja igual a 70,9 g/mol e que a constante de Faraday seja igual a 96.500 C/mol, julgue o próximo item.
seja igual a 70,9 g/mol e que a constante de Faraday seja igual a 96.500 C/mol, julgue o próximo item.Na eletrólise da solução aquosa de
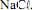 a formação do
a formação do 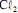 ocorre no ânodo da célula.
ocorre no ânodo da célula.  operando com uma corrente constante de 100,0 A e com rendimento de 100% para a formação de
operando com uma corrente constante de 100,0 A e com rendimento de 100% para a formação de  . Considerando que a massa molar do
. Considerando que a massa molar do  seja igual a 70,9 g/mol e que a constante de Faraday seja igual a 96.500 C/mol, julgue o próximo item.
seja igual a 70,9 g/mol e que a constante de Faraday seja igual a 96.500 C/mol, julgue o próximo item.O tempo necessário para a formação de 709 g de
 , a partir da eletrólise da solução aquosa de
, a partir da eletrólise da solução aquosa de  , é superior a 2 h.
, é superior a 2 h.  , cuja equação de combustão é
, cuja equação de combustão é . A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
. A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
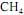 ocorra de forma completa; que a entalpia padrão de combustão do
ocorra de forma completa; que a entalpia padrão de combustão do 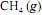 , a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
, a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.Se o consumo mensal de energia elétrica da referida empresa for de 1,0 × 1012 J, a combustão do
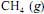 , sob pressão constante de 1 bar e a 25 ºC, produzirá mais de 40 toneladas de
, sob pressão constante de 1 bar e a 25 ºC, produzirá mais de 40 toneladas de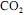 para suprir as necessidades mensais de energia da empresa.
para suprir as necessidades mensais de energia da empresa.  , cuja equação de combustão é
, cuja equação de combustão é . A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
. A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
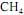 ocorra de forma completa; que a entalpia padrão de combustão do
ocorra de forma completa; que a entalpia padrão de combustão do 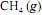 , a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
, a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.Considerando-se que as capacidades caloríficas fornecidas na tabela sejam válidas para o intervalo de temperaturas entre 25 ºC e 35 ºC, é correto afirmar que a combustão do
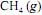 deverá liberar maior quantidade de calor se for realizada a 35 ºC, e não a 25 ºC.
deverá liberar maior quantidade de calor se for realizada a 35 ºC, e não a 25 ºC. 
A partícula denominada quark é uma das partículas fundamentais do Universo (a outra é o lépton, constituinte dos elétrons). Os quarks se caracterizam por estarem no núcleo atômico, mais precisamente nos prótons e nos nêutrons, uma vez que os prótons e os nêutrons são nada mais que uniões de quarks de determinadas cargas e massas.
O carbono radioativo ( 6 C14 ) utilizado pelos cientistas em seus experimentos de “rastreamento" é um isótopo do carbono comum ( 6 C12 ), isto é, apresenta mesmo número atômico (Z) e diferentes números de massa (A). O carbono radioativo apresenta a seguinte constituição:
O gráfico a seguir apresenta a entalpia de combustão, em certa temperatura, para o etano, o propano, o butano, o pentano e o hexano.

A energia de dissociação de ligação é uma medida da força da ligação química. É definida como a mudança de entalpia padrão observada na quebra homolítica de uma ligação a 0 K. A inclusão de correções térmicas leva os valores de energia de dissociação à entalpia padrão de dissociação, definidos a 298 K.
O diagrama de energia a seguir apresenta as variações de entalpia, a 298 K, para diversos processos.
Um experimento de eletrólise de uma solução de sulfato de cobre (II) foi conduzido por 40 minutos, aplicando-se uma corrente elétrica de 0,4A.
A massa aproximada de cobre que deverá s ser depositada no catodo, em mg, é de
Dados: Massa molar Cu= 63,55 g.mol –1 e constante de Faraday: 96500 C.
Dados: Números atômicos K = 19 e Ca = 20
Abaixo está representada a reação de combustão do metanol:
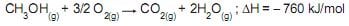
Na combustão completa de 1,0 L de metanol, no estado gasoso, a quantidade de energia liberada, em kJ, é, aproximadamente, igual a
Um exemplo de reação de oxirredução é
De forma geral, o fluxo de energia ocorre do maior potencial para o menor potencial; consequentemente, um corpo quente ende a esfriar-se ao ser posto em um ambiente mais frio que ele.
A energia nuclear refere-se às transformações que acontecem nos núcleos dos átomos, os quais, devido à forte repulsão entre os prótons (com cargas positivas) presentes no núcleo, possuem energia de ativação menor que a obtida nas transformações químicas que ocorrem no dia a dia.