Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.539 questões
Os elétrons passam do ânodo para o cátodo, os cátions movem-se através do eletrólito na direção do cátodo e os ânions na direção do ânodo.
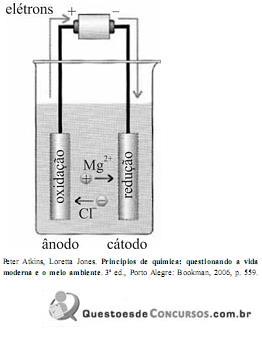
Com base nas informações e na figura acima, julgue o item.
Na célula eletrolítica mostrada na figura, a ponte salina foi removida para que os elétrons fluíssem mais rapidamente do ânodo para o cátodo.
Os elétrons passam do ânodo para o cátodo, os cátions movem-se através do eletrólito na direção do cátodo e os ânions na direção do ânodo.

Com base nas informações e na figura acima, julgue o item.
Na célula eletrolítica apresentada, o magnésio é decantado da água do mar e, então, convertido em cloreto por tratamento com ácido clorídrico. Após a evaporação da água,o MgCl2 é fundido e eletrolisado e a reação global resultante é: MgCl2 → Mg(l) + Cl2(g).
Os elétrons passam do ânodo para o cátodo, os cátions movem-se através do eletrólito na direção do cátodo e os ânions na direção do ânodo.

Com base nas informações e na figura acima, julgue o item.
A galvanização é um método utilizado para prevenir a corrosão de metais, em que um primeiro metal é encoberto por um segundo metal, devendo este segundo, para isso, estar abaixo do primeiro na série eletroquímica, uma vez que, ao sofrer deterioração, o segundo libera seus elétrons para o primeiro. Dessa forma, é correto afirmar que a galvanização é um processo eletroquímico.
Os elétrons passam do ânodo para o cátodo, os cátions movem-se através do eletrólito na direção do cátodo e os ânions na direção do ânodo.

Com base nas informações e na figura acima, julgue o item.
Considerando-se que “fund" significa sal fundido, é correto afirmar que as semirreações correspondentes ao diagrama apresentado na figura acima e as reações ocorridas no ânodo e no cátodo são:
reação do ânodo: Mg2+ (fund) + 2e- → Mg(l);
reação do cátodo: 2Cl- (fund) → Cl2(g) + 2e .
Ag1++e- → Ag E0=0,80V
Mg2++e- → Mg E0 = -2,37V
EmrelaçãoaelasNÃOécorretoafirmarque:
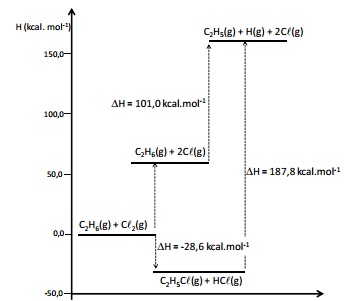
O gráfico a seguir apresenta a entalpia de combustão, em certa temperatura, para o etano, o propano, o butano, o pentano e o hexano.

A energia de dissociação de ligação é uma medida da força da ligação química. É definida como a mudança de entalpia padrão observada na quebra homolítica de uma ligação a 0 K. A inclusão de correções térmicas leva os valores de energia de dissociação à entalpia padrão de dissociação, definidos a 298 K.
O diagrama de energia a seguir apresenta as variações de entalpia, a 298 K, para diversos processos.
Um experimento de eletrólise de uma solução de sulfato de cobre (II) foi conduzido por 40 minutos, aplicando-se uma corrente elétrica de 0,4A.
A massa aproximada de cobre que deverá s ser depositada no catodo, em mg, é de
Dados: Massa molar Cu= 63,55 g.mol –1 e constante de Faraday: 96500 C.
Dados: Números atômicos K = 19 e Ca = 20
O potencial medido em volts, numa certa temperatura T e em relação ao eletrodo padrão de hidrogênio (EPH), é
Dados Da equação de Nernst: RT/F = 0,06 V
Fe 3+ + e → Fe 2+ E0 = +0,77 V
E0EPH = 0V
No entanto, nos laboratórios, o EPH não é usualmente disponível.
Utilizando-se o eletrodo saturado de calomelano (Hg2 Cl2 ) como eletrodo de referência, o novo valor medido para o potencial padrão de redução do Cu 2+será
Dados: Hg2 Cl2(s)+ 2e → 2Hg(l) + 2Cl- (aq)
Eo = +0,24 V versus EPH
O processo de separação, que é baseado na difusão desses gases, à temperatura constante, ao longo de percurso contendo placas inertes com pequenos poros é a
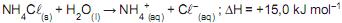
A adição de 1.000 g de cloreto de amônio a 1.000 mL de água, a 20 o C, envolve a variação de entalpia, em kJ, igual a
Dado
MNH4Cl = 53,5g mol -1
SnCl2(aq) + 2 FeCl3(aq) → SnCl4(aq)+ 2 FeCl2(aq)
Qual a concentração, em quantidade de matéria (mol/L), da espécie Sn 4+ formada?
Mg+2 + 2e ⇆ Mg E0Red = - 2,34 V
Al+3 + 3e ⇆ AlE0Red = - 1,67 V
Pb+2 + 2e ⇆ Pb E0Red = - 0,13 V
Bi +3 + 3e ⇆ Bi E0Red = + 0,21 V
Ag+1 + 1e ⇆ Ag E0Red = + 0,80 V
Qual a opção que corresponde a uma reação espontânea?
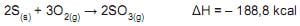
Considerando-se que há excesso de oxigênio e que ocorre reação completa, o valor do calor, em kcal, liberado na formação de 10 mol de SO 3(g) é
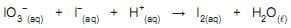
Nessa reação, o
A soma dos coeficientes da equação acima, acertados pelo método redox, corresponde a