Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.539 questões
O coordenador de um laboratório decide utilizar uma técnica eletroquímica para realizar a determinação de chumbo em amostras de efluente. Com base nessa informação, julgue o item seguinte acerca de eletroquímica.
Aferições de pH em soluções são comumente realizadas
utilizando-se um potenciômetro conectado a um eletrodo de
vidro combinado, o qual é composto, resumidamente, por dois
eletrodos de prata-cloreto de prata e pela membrana de vidro.
O coordenador de um laboratório decide utilizar uma técnica eletroquímica para realizar a determinação de chumbo em amostras de efluente. Com base nessa informação, julgue o item seguinte acerca de eletroquímica.
Utilizando-se medidas potenciométricas, a determinação de
chumbo requer, necessariamente, o uso de padrões com
concentrações conhecidas para construção de uma curva
analítica.
O coordenador de um laboratório decide utilizar uma técnica eletroquímica para realizar a determinação de chumbo em amostras de efluente. Com base nessa informação, julgue o item seguinte acerca de eletroquímica.
Pode-se realizar a determinação de chumbo nas amostras por
meio de um sistema eletroquímico composto por um eletrodo
de referência prata-cloreto de prata e um eletrodo indicador de
primeira classe constituído de uma placa de chumbo.
O coordenador de um laboratório decide utilizar uma técnica eletroquímica para realizar a determinação de chumbo em amostras de efluente. Com base nessa informação, julgue o item seguinte acerca de eletroquímica.
Quando são realizadas medidas com o eletrodo de vidro de
soluções muito ácidas, podem ser observados valores de pH
menores que os reais, que são conhecidos como erros ácidos.
Sua principal origem consiste na saturação da membrana de
vidro por íons H+
.
A corrosão é definida como a deterioração de um material, geralmente metálico, em virtude da ação do meio ambiente que o modifica por meio de um processo espontâneo. Isso pode acarretar a inutilização de estruturas de uso corrente no dia-adia.
É corrente vermos estruturas metálicas espalhadas por toda parte, seja nos meios de transporte como automóveis, caminhões, navios ou aviões, ou em gasodutos, adutoras, entre outros. Todos esses objetos ou aplicações metálicas sofrem a ação do meio, tornando-se, com o passar do tempo e com a corrosão, inadequados ao seu uso, com grandes prejuízos.
(Fonte: http://www.searadaciencia.ufc.br/sugestoes/quimica/quimica003.htm.)
A corrosão do ferro pode ser descrita pela reação:
A medicina nuclear envolve dois usos distintos de radioisótopos: terapia e diagnóstico. No uso terapêutico, a radiação é empregada na tentativa de curar doenças. Algumas formas de câncer, por exemplo, podem ser tratadas por radioterapia (...) Os radioisótopos também podem ser empregados com o propósito de diagnóstico, fornecendo informações sobre o tipo ou extensão da doença. O isótopo iodo-131 é usado para determinar o tamanho, forma e atividade da glândula tireóide. (Fonte: Química Nuclear na Medicina. http://www.qmc.ufsc.br)
A representação do iodo-131 faz referência
KMnO4(aq) + SnSO4(aq) + H2SO4(aq) → MnSO4(aq) + Sn(SO4)2(aq) + K2SO4(aq) + H2O( l)
Considere as afirmações abaixo sobre essa reação.
I - MnO4 - é o agente oxidante no meio ácido, e Sn2+ , o agente redutor.
II - No balanço de massa, 2 mol de KMnO4 reagem com 5 mol de SnSO4 .
III - Sn2+ ganha 2 elétrons do MnO4 - ao passar para Sn4+ .
É correto APENAS o que se afirma em
H2O(g) → H2(g) + ½ O2(g) ΔHo = 285 kJ
Nessa reação,
Zn+2 + 2e-1 = Zn -0,763
Fe+3+ 3e-1 = Fe -0,037
2H+1 + 2e-1 = H2 0,000
Cu+2 + 2e-1 = Cu 0,337
Fe+3 + e-1 = Fe+2 0,771
Ag+1+ e-1 = Ag 0,7991
Au+1+ e-1 = Au 1,692
A tabela de potenciais de redução é muito útil para avaliar a possibilidade de oxidação de metais distintos, unidos eletricamente e imersos em um eletrólito. A tabela acima fornece alguns valores para diferentes sistemas de oxidação.
Sendo assim, empregando-se essa tabela, verifica-se que
Essa situação está normalmente associada à corrosão
Considerando que a quantidade de eletricidade (carga) de 1 mol de elétrons é igual a 96.500 C, qual o tempo, em s, necessário para se obter 9,2 g de sódio, por esse processo, utilizando uma corrente constante e igual a 10 A?
Numa viagem de 200 km, com o carro consumindo, na média, 10 km/L, ao concluir esse percurso, a quantidade máxima de energia liberada, em kJ, será, aproximadamente, igual a
Dados: M (CH3 CH2 OH) = 46 g/mo
CH3 CH2 OH(
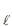 ) + 6 O2 (g) → 2 CO2 (g) + 3H2 O(
) + 6 O2 (g) → 2 CO2 (g) + 3H2 O(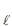 ) ΔH° = -1.400 kJ
) ΔH° = -1.400 kJSe 9,2 kg de etanol são queimados de forma completa, e o calor liberado é aproveitado com 90% de eficiência, a energia útil, em kJ, no processo, é
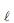 é boa condutora de eletricidade. Se essa solução for atravessada por uma corrente elétrica, serão portadores de carga os(as)
é boa condutora de eletricidade. Se essa solução for atravessada por uma corrente elétrica, serão portadores de carga os(as) K2 Cr 2 O7 (aq) + FeSO4 (aq) + H2 SO4 (aq) ? Cr 2 (SO4 ) 3 (aq) + Fe2 (SO4 ) 3 (aq) + K2 SO4 (aq) + H2 O
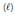
Nessa equação, verifica-se que