Questões de Concurso
Sobre transformações químicas e energia em química
Foram encontradas 1.539 questões
O processo eletroquímico de corrosão de materiais metálicos, como o ferro, pode ser representado pelas seguintes equações químicas:
4H2O(l) + 2Fe+3 (aq) ⇋ 6H+ (aq) + Fe2O3.H2O(s)
2Fe+2(aq) + 1/2O2(g) + 2H+ (aq) ⇋ 2Fe+3(aq) + H2O(l)
2Fe(s) + O2(g) + 4H+ (aq) ⇋ 2Fe+2(aq) + 2H2O(l)
Assim, quando essas equações são somadas, resultarão
na equação total balanceada da ferrugem. Os coeficientes
da equação balanceada para o Fe(s), gás oxigênio, água e
óxido de ferro (III) hidratado são, respectivamente:
Sobre potenciometria, considere as afirmativas a seguir.
I. Em um eletrodo redox, um metal inerte está em contato com uma solução contendo as espécies oxidadas e reduzidas da meia-reação redox.
II. O potencial de Junção Líquida é o causado pela pressão osmótica na interface do eletrodo e deve ser subtraído do potencial medido em soluções concentradas em íons divalentes.
III. Eletrodos de referência devem apresentar potencial fixo e estável e não devem ser afetados pela passagem das pequenas quantidades de corrente elétrica que ocorrem quando se realizam as análises.
IV. Em soluções-teste com pH acima de 9, a presença de íons como o sódio ou o potássio pode resultar em desvios na determinação do pH, registrando valores superiores ao pH real.
Assinale:
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
Os mesmos produtos produzidos na eletrólise do NaCl puro são obtidos na eletrólise de uma solução aquosa de NaCl.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
Na produção do sódio metálico, é possível realizar a eletrólise do NaCl na forma sólida.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
A partir da localização do N a e do K na tabela periódica, é correto concluir que a eletrólise do KC1 requer a aplicação de um potencial elétrico maior que aquele requerido para a eletrólise do NaCl.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
A formação de 2,0 g de sódio metálico deve ser acompanhada pela formação de uma massa superior a 4,0 g de Cl2.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
No processo, sabendo que M(Na) = 23 g/mol, a circulação de uma corrente elétrica igual a 2,0 A em um intervalo de 4.825 s deve produzir uma massa superior a 2,0 g de sódio metálico.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximos item.
O potencial elétrico mínimo (E) que deve ser aplicado à célula eletrolítica para que ocorra a eletrólise do NaCl pode ser calculado pela equação E = E (Na+/Na) + 2E (Cl2/ Cl- ) , em que E ( Na+ /Na ) e E(C12 /Cl- ) são, respectivamente, os potenciais elétricos de redução dos pares Na+/Na e Cl2/Cl- na temperatura do experimento.
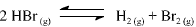
Com base nessas informações, julgue o item que se segue.
A partir dos valores da constante de equilíbrio fornecidos, é correto afirmar que a reação de decomposição do HBr(g) em H2 (g) e Br2 (g) é endotérmica.
Os dados da tabela acima se referem a testes realizados, a 298 K, utilizando-se o método das velocidades iniciais, para determinação da lei de velocidade para a reação do BO3-(aq) com o Br-(aq) em meio ácido. A equação não balanceada para essa reação é a seguinte.
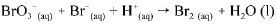
A respeito da reação acima e dos com postos nela envolvidos, e considerando as informações fornecidas, julgue o item que se segue.
A reação em questão pode ser considerada uma reação de oxi-redução.
Considere as seguintes entalpias padrões, 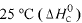
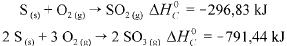
Com base nessas informações, julgue o item que se segue.
A entalpia padrão da reação 2 SO2(g) + O2(g) → 2 SO3(g), a 25
°C ,é igual a -197,78 kJ.
Considere as seguintes entalpias padrões, 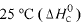
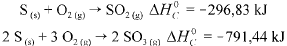
Com base nessas informações, julgue o item que se segue.
O módulo da entalpia padrão de formação do SO3(g), a 25 °C, é m aior que 700 kJ/mol.
O calor e a entalpia de combustão do ácido benzoico foram determinados por meio de um calorímetro que opera a volume constante e cuja capacidade calorífica é de 10.000 J. A queima de 1,00 g do ácido ocasionou um aumento de 2,64 °C na temperatura do sistema. A equação que representa a combustão do ácido benzoico é apresentada a seguir.
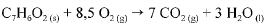
Considerando que todos os gases envolvidos na reação de combustão do ácido benzoico tenham com portamento ideal e desprezando a contribuição de líquidos e sólidos para a pressão dentro do sistema, julgue o próximo item.
O módulo da entalpia de combustão do ácido benzoico é maior
que o módulo do calor de combustão nas condições do
experimento calorimétrico realizado.
O calor e a entalpia de combustão do ácido benzoico foram determinados por meio de um calorímetro que opera a volume constante e cuja capacidade calorífica é de 10.000 J. A queima de 1,00 g do ácido ocasionou um aumento de 2,64 °C na temperatura do sistema. A equação que representa a combustão do ácido benzoico é apresentada a seguir.
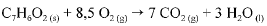
Considerando que todos os gases envolvidos na reação de combustão do ácido benzoico tenham com portamento ideal e desprezando a contribuição de líquidos e sólidos para a pressão dentro do sistema, julgue o próximo item.
Os dados fornecidos permitem concluir que o módulo do calor
de combustão a volume constante do ácido benzoico é maior
que 400 kJ/mol.
