Questões de Concurso
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 1.107 questões
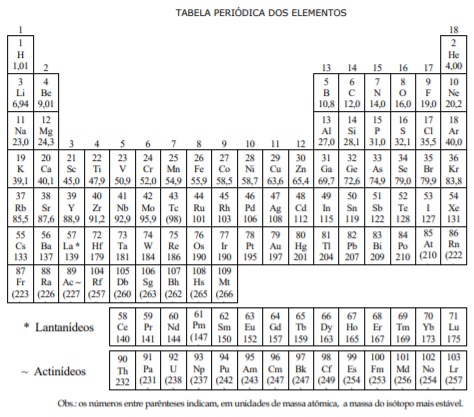
Abaixo se encontra representada a tabela periódica com quatro elementos destacados, denominados D, R, X e K (esses não são os símbolos reais dos elementos).
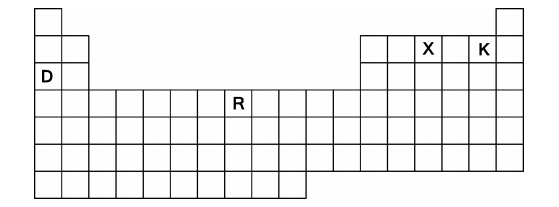
Sobre esses elementos, um estudante escreve: “Os elementos D, R, X e K são muito comuns na natureza. D possui
_______________acentuado e forma com K o composto________ DK. R é ___________ na temperatura ambiente e X
existe em_____________na atmosfera terrestre.” Os espaços em branco são corretamente preenchidos, na ordem, por:
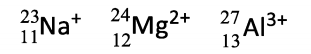
Sobre esses íons, analise as afirmações a seguir. 1) A ordem crescente de raio iônico é Al3+< Mg2+ < Na+. 2) São isoeletrônicos, pois possuem o mesmo número de elétrons. 3) Os cátions sódio e magnésio são isótonos.
Está(ão) correto(s):
O ácido monoprótico, representado por HX, é misturado com excesso de Ba(OH)2 , reagindo segundo a equação abaixo.

Foram obtidos 15,00 g do produto BaX2 que foram quantitativamente reagidos com exatamente 59,00 mL de uma solução aquosa de ácido sulfúrico 1,00 mol L-1 , como mostrado na equação abaixo.
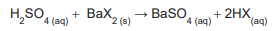
A partir dos dados do experimento, calculou-se a massa
molar de HX, em g mol -1
, e concluiu-se que era de 
Um volume de 1,00 mL de um adoçante líquido à base de sacarina sódica (representada por SacNa) foi colocado num Erlenmeyer, onde também se adicionou 100 mL de água pura. A sacarina sódica reagiu exatamente com 22,00 mL de uma solução padronizada de AgNO3 (0,500 mol L-1 ) para precipitar quantitativamente a sacarina, conforme equação abaixo. No resultado, já se considerou a correção do branco.
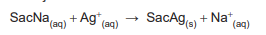
A concentração de sacarina, em g mL-1
, no adoçante, é
mais próxima de
O íon chumbo pode ser determinado por gravimetria, na forma de cromato de chumbo (PbCrO4(s)), usando agente de
precipitação homogênea. Isso é alcançado pela adição de excesso de cloreto de cromo (III), que produz o íon cromato ao
ser oxidado pelo bromato (BrO3 -), também adicionado em excesso. A sequência resumida de reações é indicada abaixo:
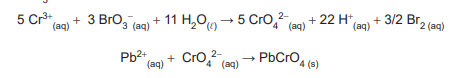
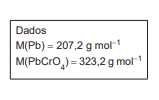
Uma alíquota de 60,000 g de resíduo foi totalmente dissolvido e submetido ao procedimento analítico gravimétrico em questão. A massa de 12,542 g de precipitado (após secagem até massa constante) foi obtida.
A percentagem (m/m) de chumbo presente na amostra foi de
Em uma prática de laboratório, 1 L de solução aquosa foi obtido ao se misturar 600 mL de solução 0,010 mol/L de cloreto férrico e 400 mL de solução 0,020 mol/L de cloreto de cálcio.
Admitindo-se completa dissociação dos sais, a concentração de íons cloreto na mistura formada, em mol/L, é igual a
Ácido sulfúrico em excesso foi adicionado a uma amostra de 150 g de alumínio metálico impuro, verificando-se a formação de 10 g de H2 , após a completa reação do alumínio.
Admitindo-se que as impurezas presentes não reagiram
com o ácido, o grau de pureza do alumínio é igual a
Em uma unidade industrial, é feita a seguinte reação química:
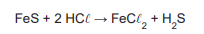
Nessa unidade, adicionaram-se 440 kg de FeS e 146 kg
de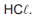
Admitindo-se que o reagente limitante foi totalmente consumido, a massa de reagente em excesso, em kg, que não participou da reação é igual a

A reação química entre soluções aquosas de  e
NaOH acarreta a formação de um produto com aroma característico.
e
NaOH acarreta a formação de um produto com aroma característico.
Esse produto corresponde a
O óxido de zinco é um composto anfótero, reagindo tanto com ácidos fortes quanto com bases fortes.
O produto formado na reação do óxido de zinco com hidróxido de sódio tem a seguinte fórmula química:
I. Algumas gotas da solução do tubo 1 foram adicionadas a um certo volume de solução do tubo 2. Não foi observado reação aparente, no entanto houve aquecimento do tubo.
II. Algumas gotas da solução do tubo 1 foram adicionadas a um certo volume de solução do tubo 3. Foi observada a formação de gás.
Com base nas informações, pode-se concluir que as soluções presentes nos tubos 1, 2 e 3 são, respectivamente: