Questões de Concurso
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 1.107 questões
Considere os seguintes valores de eletronegatividade de Pauling.
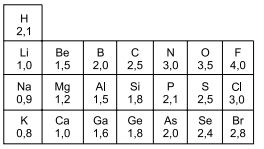
O caráter iônico é mais acentuado na ligação entre os
átomos de
NaHCO3 + CH3COOH → CH3COONa + CO2 + H2O
O elemento químico Boro, forma extraordinárias estruturas. É minerado como bórax e quernita, Na2B4O7. x H2O, com x =10 e 4, respectivamente. Grandes depósitos desse metalóide são encontrados em regiões vulcânicas, sendo na região do Deserto de Monjave, Califórnia, a maior fonte de Boro sob a forma de quernita.
Sobre o boro, analise as seguintes sentenças:
I. Apresenta octeto incompleto em todos os seus compostos
II. Possui alta energia de ionização
III.Forma ligações covalentes com o silício
IV.É comumente encontrado como sólido não metálico com baixo ponto de fusão
V. Alguns de seus compostos têm octetos incompletos e outros são eletrodeficientes
Das sentenças citadas acima, estão corretas:
Alguns besouros do gênero Brachinus, quando ameaçados, lançam em seus predadores jatos quentes de água juntamente com compostos tóxicos, os quais ficaram conhecidos como “besouros-bombardeiros”. A reação química que representa
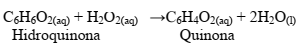
Sobre esta reação orgânica, NÃO podemos afirmar que:
Sobre os elementos da família 7A ou 17 da Tabela Periódica, analise as seguintes afirmações:
I. São chamados calcogênios.
II. O cloro é muito reativo, reage explosivamente como hidrogênio quando exposto à luz e ataca praticamente todos os metais.
III.Tem caráter ametálico e sua afinidade eletrônica aumenta com o número atômico.
A alternativa que indica, apenas a(s) afirmação (ões) verdadeira(s) é:
O sulfato ferroso (FeSO4) reage com o permanganato de potássio (KMnO4) em meio ácido seguindo a reação não balanceada reproduzida abaixo.
aFeSO4(aq) + bKMnO4(aq) + cH2SO4(aq) → dFe2(SO4)3(aq) + eMnSO4(aq) + ƒK2SO4(aq) + gH2O(l)
Os coeficientes estequiométricos indicados por a e f correspondem, respectivamente, a
Uma amostra que pesa 1,55 g contém fósforo na forma de dihidrogenofosfato de sódio (NaH2PO4). Após receber tratamento adequado, a amostra foi misturada com solução de íons magnésio (Mg2+) e com solução de íons amônio, obtendo-se um precipitado de fosfato duplo de magnésio e amônio, conforme a reação a seguir:
H2PO4- + Mg2+ + NH4+ + 6H2O → MgNH4PO4 ˑ 6H2O(s) + 2H+
No procedimento de análise, o precipitado, após lavado e seco, foi decomposto a pirofosfato de magnésio (Mg2P2O7) conforme a reação abaixo.
2MgNH4PO4 ˑ 6H2O(s) 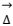 Mg2P2O7(s) + 2NH3(g) + 13H2O(g)
Mg2P2O7(s) + 2NH3(g) + 13H2O(g)
Se a massa de pirofosfato de magnésio obtida foi de 1,11 g, o teor de fósforo na amostra é
A calcinação do sulfato de bário, em condições de reagir, fornece duas espécies, sendo uma delas um óxido gasoso de enxofre e a outra um óxido básico. A massa, em gramas, do referido gás, obtida a partir de 0,5 mol de sulfato de bário, é de:
Dado: Ba= 137,5.
A calcinação do dicromato de amônio produz três espécies químicas, entre elas gás nitrogênio e água. A massa, em gramas, de gás nitrogênio produzida a partir da calcinação de 126g do sal citado é:
Dados: Cr=52,0 e N= 14,0.
O carvão é uma espécie química que contém carbono puro e impurezas. Tendo como base tal informação, o volume, em litros, de gás carbônico obtido pela queima de 1 kg de carvão a 96% é:
Dado: C=12.
O minério chamado “blenda” é utilizado na obtenção de zinco. Sabendo-se que uma amostra de tal minério contém 90% de pureza, a massa, em gramas, de zinco que pode ser obtida a partir de 200g de blenda é de:
Dados: Zn=65 e S=32.
A calcinação de 1,0 mol de sulfato de amônio formará quatro substâncias, sendo uma delas o gás amônia. A massa de gás amônia, em gramas, produzida na referida reação será de:
Dados: Ca=40; S=32; O=16 e H=1.