Questões de Concurso
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 1.138 questões
Uma amostra de 50 mL de água contendo cátions Fe3+ foi tratada com excesso de NH4OH. O precipitado obtido depois de lavado, secado e calcinado pesou 0,320 g. A quantidade de ferro, em mol/L presente na amostra é
Dados:
Massas molares em g/mol
Fe = 56
O = 16
H = 1
N = 14
Na combustão da gasolina comum, um de seus componentes − o isooctano é padrão para a qualidade da gasolina. Quanto maior é o índice de octanagem, maior é a compressão que a mistura gasolina-ar suporta no motor, sem detonação prematura; portanto, melhor é a qualidade da gasolina.
A fórmula molecular do isooctano é C8H18. A gasolina pode sofrer combustão completa produzindo CO2 e água ou incompleta − produzindo CO e água ou C (fuligem) e água. Isso ocorre de acordo com a quantidade de oxigênio: combustões completas ocorrem com quantidade de oxigênio suficiente para consumir todo combustível. Por outro lado, a combustão se dá de forma incompleta quando não houver oxigênio suficiente para consumir todo o combustível.
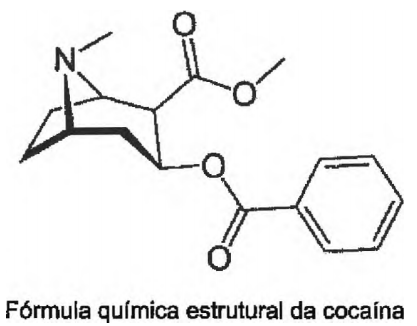
Um Perito Criminal Especial, ao realizar análise química qualitativa preliminar para identificação de cocaína, efetua as reações químicas descritas abaixo. Identifique a resposta que correlaciona corretamente a reação química com o princípio da técnica empregado.
O etanol é uma substância com fórmula molecular C2H6O, produzida especialmente via fermentação de açúcares. É um biocombustível utilizado em motores de combustão interna com ignição por centelha, em substituição especialmente à gasolina. O Brasil é pioneiro na utilização em larga escala de etanol combustível desde o fim da década de 1970. Atualmente, é um dos que mais utilizam o produto e ainda o segundo maior produtor mundial. São duas as formas de utilização do produto: na forma de etanol anidro, como componente de mistura na formação da gasolina C; ou como etanol hidratado, comercializado em todo o País como um combustível acabado.
Internet: <www.anp.gov.br> (com adaptações).
Julgue o item quanto às características do etanol e a assuntos correlatos ao texto acima.
A combustão completa do etanol pode ser representada pela equação química C2H6O → 2 CO + 3 H2O.
No que concerne à classificação periódica dos elementos e às ligações químicas, julgue o item.
A ligação covalente consiste em um par de elétrons entre dois átomos. Nessa ligação, a nuvem eletrônica do par de elétrons é aproximada de um dos átomos ligados (por causa das diferentes tendências de ganhar e perder elétrons), ocorrendo a transferência total de pelo menos um dos elétrons envolvidos na ligação e balanceando‐se as forças atrativas e repulsivas.
No que concerne à classificação periódica dos elementos e às ligações químicas, julgue o item.
Na ligação iônica, as forças eletrostáticas atraem os íons de cargas opostas (cátions e ânions). Uma amostra de NaCℓ sólido consiste em íons Na+
e Cℓ−
, ordenados em três dimensões, onde cada íon Na+ tem seis íons Cℓ−
como vizinhos mais próximos e, da mesma forma, a vizinhança mais próxima de cada Cℓ− consiste em seis íons Na+
.
No que concerne à classificação periódica dos elementos e às ligações químicas, julgue o item.
Energia de ionização é a energia máxima necessária para remover um elétron do estado excitado de um átomo isolado, uma molécula ou um íon no estado gasoso.
No que concerne à classificação periódica dos elementos e às ligações químicas, julgue o item.
A lei periódica estabelece que, quando os elementos são sequencialmente listados, em ordem crescente do número atômico, é observada uma repetição periódica em suas propriedades, resultado da periodicidade nas
configurações eletrônicas de seus átomos.
Das raízes da mandioca brava é obtido o caldo amarelado conhecido como tucupi. Em uma análise
química do tucupi, além de carbono, hidrogênio, nitrogênio e oxigênio (elementos presentes em
compostos orgânicos), foram encontrados também Ca, Cu, Fe, K, Mg, Mn, Na e Zn. Com base nesse
conjunto de informações, responda a questão.
I. A primeira energia de ionização, I1, é a quantidade de energia necessária para remover o elétron mais fracamente ligado de um átomo gasoso. II. A afinidade eletrônica é a alteração de energia quando um átomo gasoso ganha um elétron para formar um íon gasoso. III. É modo geral, ao longo de um período, a carga nuclear efetiva Zef aumenta e, consequentemente, fica mais difícil remover um elétron.
Está(Estão) correta(s) a(s) afirmativa(s)
A configuração eletrônica do átomo de ferro Fe e seu íon Fe (III) são, respectivamente,
Dado: número atômico do Fe= 26
Um estudante misturou 50 mL de solução aquosa de ácido sulfúrico 0,10 mol/L com 50 mL de solução aquosa de hidróxido de sódio 0,40 mol/L e introduziu algumas gotas de fenolftaleina. O processo pode ser representado pela equação não balanceada:
H2SO4(aq) + NaOH(aq) → Na2SO4(aq) + H2O(l)
Ao término da reação, pode-se concluir acertadamente que