Questões de Concurso
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 1.107 questões
Os átomos de um determinado elemento químico têm a configuração eletrônica:
[configuração de um gás nobre] 3s2 3p1 .
O gás nobre que tem configuração eletrônica igual à configuração indicada entre colchetes é o
Uma amostra de minério (5,00 g) foi completamente dissolvida em ácido e o volume ajustado para 100,00 mL. Uma alíquota de 10,00 mL dessa solução aquosa foi misturada, de forma lenta e sob agitação constante, com excesso de solução aquosa de hidróxido de amônio, suficiente para promover a precipitação completa de ferro na forma de Fe(OH)3 .
Fe3+ (aq) + 3OH- (aq) → Fe(OH)3 (s)
Após envelhecer, em sua água mãe, filtrar e lavar, o precipitado foi calcinado em forno mufla para formar Fe2O3 , que depois foi deixado para resfriar, em dessecador, até massa constante.
2 Fe(OH)3(s) → Fe2O3(s) + 3H2O(g)
Sendo a massa de Fe2O3(s), obtida após a calcinação, igual a 3,84 g, o valor mais próximo da percentagem (massa/ massa) de ferro no minério é
Dado
M (Fe) = 56 g mol-1
M (Fe2O3
) = 160 g mol-1
O nióbio é um elemento usado para produção de aços com propriedades especiais. Na natureza, ele ocorre na forma de pentóxido de nióbio, de onde se pode obter o nióbio metálico por um processo térmico, usando uma mistura de alumínio e óxido de ferro (III), como mostrado na equação química a seguir.
3 Nb2O5(s) + Fe2O3(s) + 12 Al(s) → 6 Nb(s) + 2 Fe(s) + 6 Al2O3(s)
O processo térmico em questão produz o nióbio metálico com rendimento de 80%.
O valor aproximado da massa de Nb, em tonelada, que seria obtida a partir de 1,6 toneladas de Nb2O5 é
Dados
M (Nb) = 93 g mol-1
M (Nb2O5
) = 266 g mol-1
A reação representada na equação abaixo é lenta e reversível, mas seu rendimento é melhorado com a adição de quantidades catalíticas de ácido sulfúrico.
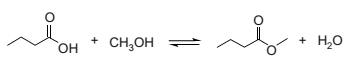
Nessa reação,
Nos diversos refrigerantes, o ácido fosfórico é utilizado como acidulante. Em cada lata de refrigerante são utilizados aproximadamente 35 mg de ácido fosfórico. Aproximadamente, quantas latas de refrigerante serão necessárias para que esse ácido, adicionado ao bicarbonato ácido de sódio, produza CO2 suficiente para encher um balão de festa com um volume de 3 litros?
(Dados: Pressão = 1 atm; Temperatura
= 25° C; R = 0,082 atm L mol -1
K
-1)
A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
Os elementos metálicos caracterizam-se por apresentarem
elevadas afinidade eletrônica e energia de ionização.
A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
Com exceção do hélio, os gases nobres possuem oito elétrons
de valência e, por esse motivo, não são capazes de
compartilhar elétrons para formar ligações covalentes.
A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
A proposta de existência de órbitas com trajetórias bem
definidas para os elétrons de um átomo, conforme ilustrado
na figura, mostrou-se, mais tarde, ser um equívoco, visto que
os elétrons apresentam propriedades de ondas e, portanto,
não podem ser descritos como partículas com trajetórias
bem definidas.
A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
De acordo com a tabela periódica atual, os elementos de um
mesmo período, por apresentarem o mesmo número de elétrons
de valência, formam compostos químicos com características
semelhantes.
A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
As primeiras propostas de tabela periódica baseavam-se
na massa atômica dos elementos como critério de alocação dos
elementos ao longo da tabela, o que causava algumas
incoerências que, mais tarde, foram sanadas com a adoção
do número atômico como critério.
De acordo com a nova definição de mol recomendada pela IUPAC, um mol contém exatamente 6,02214076 × 1023 entidades elementares. Esse número é o valor numérico fixo da constante Avogadro, NA, quando expresso em mol-1 , e é chamado de número de Avogadro. A nova definição enfatiza que a quantidade de substância está relacionada com as entidades de contagem em vez da massa de uma amostra.
Internet:<https://iupac.org>
Com relação a essas informações, julgue o item que se segue.
Considere que m1 gramas de H2(g) reajam completamente
com 6,0 gramas de C(s), de acordo com a reação I,
e que m2 gramas de O2(g) reajam completamente com
6,0 gramas de C(s), de acordo com a reação II. Conforme
a lei de Richter, são necessários 2 × m1 gramas de H2(g) para
reagir completamente com m2 gramas de O2(g), de acordo
com a reação III.
De acordo com a nova definição de mol recomendada pela IUPAC, um mol contém exatamente 6,02214076 × 1023 entidades elementares. Esse número é o valor numérico fixo da constante Avogadro, NA, quando expresso em mol-1 , e é chamado de número de Avogadro. A nova definição enfatiza que a quantidade de substância está relacionada com as entidades de contagem em vez da massa de uma amostra.
Internet:<https://iupac.org>
Com relação a essas informações, julgue o item que se segue.
De acordo com a reação I, são necessárias mais de 24 × 1023
moléculas de H2(g) para a formação de 32,0 g de metano.
A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
4KNO3(s) + 7C(s) + S(s) →
3CO2(g) + 3CO(g) + 2N2(g) + K2CO3(s) + K2S(s)
Acerca desse assunto, julgue o próximo item.
Sendo a pólvora formada somente por salitre, enxofre e carvão,
na mesma proporção molar da reação apresentada, a queima
de 10,0 g de pólvora produzirá mais de 3,0 g de sulfeto
de potássio (K2S).
