Questões de Concurso
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 1.169 questões
Um tubo inicialmente cheio de água (B) foi conectado a outro tubo (A), ao qual foi adicionada solução de ácido clorídrico e raspas de zinco com alto grau de pureza. O sistema foi fechado e após algum tempo, apresentava-se como indicado na figura.
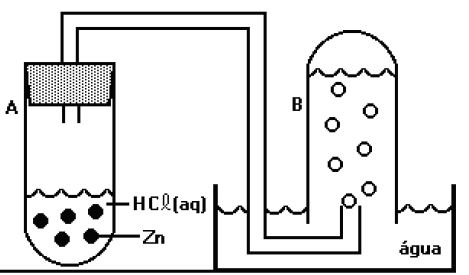
Analise as propostas a seguir:
I. Parte significativa do gás hidrogênio ficará retida na água formando uma solução de caráter ácido.
II. A pressão de vapor da água, na temperatura da realização do experimento, é importante para o cálculo sobre o volume de hidrogênio, caso não se leve em consideração a pressão de vapor da água o valor de gás hidrogênio obtido será maior que o verdadeiro.
III. Quando o nível da água no interior do tubo B se igualar com o nível da água do restante da cuba, pode-se afirmar que a soma da pressão do hidrogênio com a pressão de vapor da água, na temperatura de realização do experimento, será praticamente igual à pressão atmosférica local. Assinale a alternativa que contém as propostas verdadeiras.
Assinale a alternativa que contém as propostas verdadeiras:
“Em 1868, Mendeleiev estava debruçado sobre o problema dos elementos químicos. Eles eram o alfabeto de que a língua do universo se compunha.”
(STRATHERN, P. O sonho de Mendeleiev. A verdadeira história da química. 2002, Zahar, p. 11).
Com relação à Tabela Periódica proposta por Mendeleiev, analise as afirmativas a seguir.
I. Organizou a tabela em função dos números atômicos dos elementos.
II. Propôs seu nome para um elemento que ainda não havia sido descoberto, o Mendelévio.
III. Deixou lacunas na Tabela quando parecia que o elemento correspondente não tinha sido descoberto.
Assinale:
Leia o fragmento a seguir.
“Os conteúdos químicos de natureza simbólica estão agrupados no nível representacional, que compreende informações inerentes à linguagem química, como fórmulas e equações químicas. O aspecto representacional inclui ferramentas simbólicas para representar a compreensão dos processos de idas e vindas entre teoria e experimento. (...) Nas análises do momento discursivo que denominei Elaborando uma Forma Química de Pensar, a questão dessa dimensão constitutiva da linguagem química adquire visibilidade.”
(MACHADO, A.H. Aula de Química: discurso e conhecimento. Ed. UNIJUÍ, Ijuí, 3ª ed., 2014.)
Sobre as concepções estabelecidas pela autora sobre o momento discursivo, analise as afirmativas a seguir.
I. Para entender as equações químicas os alunos devem aprender uma série de conceitos.
II. A equação química e a linguagem química são instrumentos para a elaboração do pensamento químico.
III. A partir da linguagem química, no movimento de significação das representações vai se constituindo certa forma de pensamento.
Assinale:
Leia o fragmento a seguir.
“O objetivo da atividade é evidenciar que esse tipo de transformação envolve a formação de novas substâncias e que podem ser acompanhadas de aspectos facilmente perceptíveis ou evidências.”
(MACHADO, A.H. Aula de Química: discurso e conhecimento. Ed. UNIJUÍ, Ijuí, 3ª ed., 2014.)
Em uma das práticas apresentadas pela autora, os alunos deveriam misturar em um tubo de ensaio três gotas de solução de nitrato de chumbo II e três gotas de bicromato de potássio.
Ao realizar esse experimento, os alunos deveriam observar
Uma amostra de 50 mL de água contendo cátions Fe3+ foi tratada com excesso de NH4OH. O precipitado obtido depois de lavado, secado e calcinado pesou 0,320 g. A quantidade de ferro, em mol/L presente na amostra é
Dados:
Massas molares em g/mol
Fe = 56
O = 16
H = 1
N = 14
Na combustão da gasolina comum, um de seus componentes − o isooctano é padrão para a qualidade da gasolina. Quanto maior é o índice de octanagem, maior é a compressão que a mistura gasolina-ar suporta no motor, sem detonação prematura; portanto, melhor é a qualidade da gasolina.
A fórmula molecular do isooctano é C8H18. A gasolina pode sofrer combustão completa produzindo CO2 e água ou incompleta − produzindo CO e água ou C (fuligem) e água. Isso ocorre de acordo com a quantidade de oxigênio: combustões completas ocorrem com quantidade de oxigênio suficiente para consumir todo combustível. Por outro lado, a combustão se dá de forma incompleta quando não houver oxigênio suficiente para consumir todo o combustível.
Uma professora propõe uma aula à beira do mar para observar transformações químicas visíveis que a maresia provoca nesse ambiente. Maresia é o nome dado a uma névoa fina, úmida e salgada que às vezes paira sobre as cidades do litoral, flutuando ao longo da costa. Esse spray é formado por bilhões de gotículas de água do mar, que sobem ao ar toda vez que uma onda arrebenta na praia. O fenômeno que essa névoa provoca é retratado pelos estudantes, ao caminhar pela praia, e apresentado abaixo.

O processo químico apresentado nessas imagens pode ser classificado como uma reação de
Um pesquisador reagiu 146g de ácido clorídrico (HCℓ) com 116g de hidróxido de magnésio [Mg(OH)2], segundo a reação química abaixo:
2 HCℓ + Mg(OH)2 → MgCℓ2 + 2 H2O
Sabendo que foi produzido 72g de água (H2O), a quantidade formada de cloreto de magnésio
(MgCℓ2) foi de
“O chumbo é o segundo metal pesado mais perigoso, ao lado do mercúrio, do arsênio e do cádmio. Ele causa asma, problemas gástricos, retardamento mental, entre outros”.
O chumbo (Z=82), elemento de grande utilidade, está localizado na tabela periódica
Uma das matérias primas utilizadas na fabricação do cimento é o óxido de cálcio, também conhecido como cal virgem. Esse óxido pode ser obtido a partir da reação de decomposição do carbonato de cálcio, conforme mostra a equação abaixo:
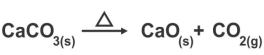
Quantos gramas de óxido de cálcio podem ser obtidos a partir da decomposição de 300 g de
carbonato de cálcio?
A reação de cloro gasoso com uma base forte pode ser descrita pela equação
Cℓ2(g) + 2 NaOH(aq) → NaCℓ(aq) + NaOCℓ(aq) + H2O(ℓ)
Para o posterior preparo de 0,5 litro de solução 0,2 mol.L–1 de hipoclorito de sódio obtido por meio desse processo, a massa de hidróxido de sódio que deve reagir em presença de excesso de cloro gasoso é, no mínimo, igual a
Dados: Massas molares H = 1g.mol–1 ; O = 16g.mol–1 Na = 23g.mol–1
Gráficos de energia potencial para a formação de moléculas ou íons moleculares são bastante úteis, pois podem ser utilizados para a obtenção de parâmetros importantes como distância de ligação (DL) e energia de ligação. Observe o gráfico a seguir.
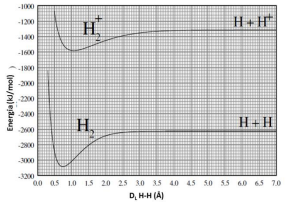
A partir das informações que podem ser extraídas do gráfico, é CORRETO afirmar que:
A utilização de um determinado elemento químico requer o conhecimento de suas propriedades. Para materiais condutores, por exemplo, são utilizados elementos metálicos, os quais podem ser moldados na forma de fios. As propriedades dos elementos, entre elas a condutividade, estão ligadas à sua configuração eletrônica de valência, que, por sua vez, pode ser obtida a partir dos valores sucessivos de energia de ionização (E.I). A partir da configuração eletrônica de valência, pode-se determinar a qual grupo da tabela periódica um elemento representativo pertence. Uma grande variação relativa do valor da E.I indica que o elétron é retirado de uma camada mais interna e os anteriores, consequentemente, da camada de valência. Observe os Quadros 1 e 2.
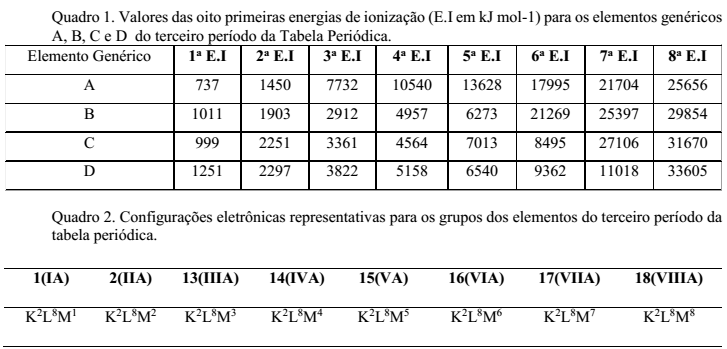
O elemento genérico adequado para obtenção de um fio condutor é:
Uma das formas de produção da amônia é a partir da reação entre a cal viva (óxido de cálcio) e o cloreto de amônio, conforme reação a seguir:
CaO(s) + 2 NH4Cl(s) → 2 NH3(g) + H2O(g) + CaCl2(s)
10 g de uma amostra de cal viva foram colocados para reagir com excesso de cloreto de amônio e foram produzidos 5 g de amônia. Qual a porcentagem de óxido de cálcio dessa amostra de cal viva?
Dados: CaO (56 g mol-1 )
NH4Cl (53,5 g mol-1 )
NH3 (17 g mol-1 )
H2O (18 g mol-1 )
CaCl2 (111 g mol-1
)
O cloreto de titânio(IV), TiCl4, é um importante produto químico industrial. Esse pode ser usado tanto na obtenção do TiO2 quanto de titânio metálico. O TiCl4 pode ser obtido a partir de um minério contendo titânio (TiO2 impuro), utilizado em excesso, com carbono e gás cloro, conforme a equação química a seguir.
TiO2(s) + 2 Cl2(g) + C(s) → TiCl4(l) + CO2(g)
Considere que a obtenção do TiCl4 seja feita a partir de 852 g de C e 852 g de Cl2.
Dados: Cl2 (71 g mol-1 ); C (12 g mol-1 ) e TiCl4 (190 g mol-1 )
O reagente limitante e a massa em gramas de TiCl4 obtida são, respectivamente: