Questões de Concurso
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 1.107 questões
Uma indústria que fabrica suplemento mineral do tipo “fosfacálcio”, utilizado na alimentação de aves de postura, realiza processo em batelada. Ao reagir 500kg de calcário com teor de 80% em carbonato de cálcio, com solução suficiente de ácido fosfórico, produz monohidrogeno fosfato de cálcio.
A massa de sal produzida, em kg, é igual a
A nitroglicerina é um líquido oleoso de cor amarelo-pálido, muito sensível ao impacto. É um dos explosivos mais fortes que existem. Sua decomposição ocorre conforme mostra a equação a seguir:

Sobre os possíveis motivos que justificam seu alto poder explosivo, foram feitas as seguintes
afirmações:
I. A energia de ligação entre os átomos de Nitrogênio, assim como entre C e O e entre H e O, são muito fortes.
II. Os produtos gasosos aumentam a pressão, consequentemente, seu poder destrutivo.
III. O aumento do grau de desordem do sistema torna a equação altamente favorável, em acordo com a segunda lei da termodinâmica.
IV. Processos endotérmicos liberam grande quantidade de energia.
O Níquel metálico reage com o ácido clorídrico conforme a reação abaixo, não balanceada:
Partindo de 17,6g de Níquel e ácido clorídrico em excesso, a massa de cloreto de níquel III e o volume
de gás Hidrogênio liberado nas CNTP serão, respectivamente,
Sobre tais elementos, assinale a afirmativa correta.
Atenção: Para responder à questão, considere as informações abaixo.
A principal fonte de sulfeto em águas naturais é o lançamento de esgotos sanitários e de efluentes industriais que contenham sulfato, em condições anaeróbias. Devido à ação biológica, ocorre a transformação do sulfato. Em menor proporção, o íon sulfeto pode também ser gerado da decomposição biológica de matéria orgânica contendo enxofre, notadamente as proteínas albuminoides. A seguinte equação química (não balanceada) representa a redução de sulfato a sulfeto em meio anaeróbio pelas bactérias do gênero Desulphovibrio desulphuricans:”
(w)SO42- + (x)C + (y) H2O → (z1) (HCO3)- + (z2) H2S
(Extraído e adaptado de: http://www.leb.esalq.usp.br/disciplinas/Fernando/leb360/Fasciculo%207%20-%20Anions%20em%20Aguas.pdf. P.5)
Propriedades periódicas são aquelas definidas na tabela periódica, conforme a variação do número atômico (Z) dos elementos químicos. Sobre o tema, marque V para as afirmativas verdadeiras e F para as falsas.
( ) A eletronegatividade diminui no período da esquerda para a direita e na família de baixo para cima.
( ) A eletroafinidade aumenta no período da esquerda para a direita e na família de cima para baixo.
( ) O potencial de ionização diminui no período da direita para a esquerda e na família de cima para baixo.
A sequência está correta em
O estudo da tabela periódica mostrou que um grande número de propriedades físicas e químicas variavam conforme a variação do número atômico dos elementos químicos. Estas propriedades são as chamadas propriedades periódicas. Assinale a alternativa INCORRETA acerca das propriedades periódicas.
(Considere apenas elementos neutros e desconsidere os íons.)
Observe as reações químicas a baixo e marque a afirmativa correta.

Considere as reações químicas abaixo e responda:
1) HCl + NaOH → NaCl+ H2O
2) 2HCl + Mg(OH)2 → MgCl2 + 2H2O
3) HCl + Al(OH)3 → AlCl3 + 3H2O
Para cada átomo a seguir foi atribuído um número.
(0)Li (3)Be (6)F (10)Cl (20)Na
A soma dos números que correspondem ao
átomo com o maior raio e ao átomo com a maior
primeira energia de ionização é:
(FIRME, L. P.; VILLANUEVA, F. C. A.; RODELLA, A. A. Solo contaminado com cádmio: extratibilidade do metal e cinética química de degradação da matéria orgânica de torta de filtro. Química Nova, 30 jun. 2014.)
Sobre o metal Cádmio, avalie as frases abaixo e assinale a alternativa em que (todas) a(s) afirmativa(s) está(ão) CORRETA(S):
I. Apresenta seus elétrons distribuídos em cinco níveis de energia. II. Seus dois elétrons mais energéticos estão no subnível 5s. III. Seus elétrons de valência apresentam número quântico principal igual a cinco e número quântico do momento angular do orbital igual a zero.
O carbonato de cálcio reage com o ácido bromídrico produzindo brometo de cálcio de acordo com a reação apresentada abaixo:
CaCO3 + HBr → CaBr2 + H2O + CO2
Indique a massa, em gramas, de brometo de cálcio obtida quando 20 g de carbonato reagem com 15 g de ácido bromídrico. Considere que Ca = 40 u; C = 12 u; O = 16 u; H = 1u e Br = 80u.
Analise as reações abaixo.
I. SO2 + H2O2 -› H2SO4
II. SO2 + H2O -› H2SO3
III. SO2 + NH4OH -› NH4HSO3
Das reações, ocorre o fenômeno de oxirredução em
A análise da concentração de ortofosfato em corpos d’água pode ser feita utilizando o método colorimétrico. Nesse método, o reagente combinado contendo K(SbO)C4H4O6, (NH4)6Mo7O24 e ácido ascórbico reage em meio ácido com o ortofosfato, produzindo uma cor azul, cuja intensidade é determinada no espectrofotômetro.
No preparo de 100 mL do reagente combinado utiliza-se 5 mL de uma solução de K(SbO)C4H4O6 3,5 g.L-1 e 15 mL de uma solução de (NH4)6Mo7O24 40 g.L-1.
Nessa solução do reagente combinado as concentrações
aproximadas (em g.L-1 ) de K(SbO)C4H4O6 e de (NH4)6Mo7O24 são,
respectivamente,
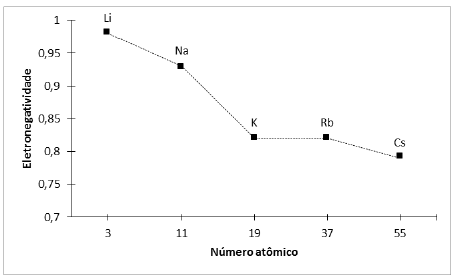
De acordo com os dados apresentados, o metal alcalino que estabelecerá com o flúor a ligação química de maior caráter iônico será o