Questões de Concurso
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 1.107 questões
O posicionamento dos metaloides entre os metais e os não-metais é o nosso primeiro exemplo das tendências na variação das propriedades quando nos deslocamos na tabela periódica. Frequentemente veremos que, à medida que mudamos de posição em um período ou em um grupo, as propriedades físicas e químicas variam de modo mais ou menos regular. Há poucas variações abruptas nas características dos elementos quando nos deslocamos horizontalmente ao longo de um período ou verticalmente através de um grupo.
(Brady, J.; Senese, F. Química a matéria e suas transformações Vol 1, 5ª Ed. Rio de janeiro: LTC. 2009)
Com relação aos raios dos átomos, analise as afirmativas a seguir.
I. O raio do ferro é menor que o raio do potássio.
II. O raio do paládio é maior que o raio do níquel.
III. O raio do manganês e maior que o raio do estrôncio
Está correto o que se afirma em
 )
) Esta reação, descoberta pelo químico francês Paul Sabatier, tem sido estudada para remover CO2 de atmosferas artificiais como em espaçonaves. Considerando que um indivíduo libere para o ambiente 0,6 kg de dióxido de carbono por dia, e que 80% desse gás será removido pelo processo de Sabatier, a massa de metano produzida por dia é de Dados: Massas Molares: H = 1g.mol-1 C = 12g.mol-1 O=16g.mol-1
Em um laboratório foi montada uma aparelhagem para recolhimento do gás oxigênio produzido na reação de decomposição do clorato de potássio, como ilustra a figura a seguir.
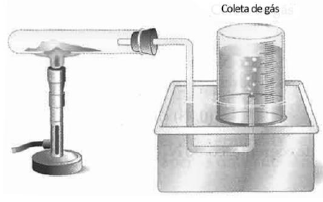
A reação observada pode ser representada pela equação:
2 KClO3 → 2 KCl+ 3 O2
Uma amostra de clorato de potássio foi parcialmente decomposta sendo a pressão do gás recolhido de 0,8 atm e seu volume de 180 mL na temperatura de 27ºC. Considerando o comportamento ideal do gás, a massa de clorato de potássio que sofreu decomposição foi de, aproximadamente,
Dados: Massa Molar: KClO3 = 122,5 g.mol-1
Constante real dos gases R= 0,082atm.L.mol-1 .K-1
 CH4
(g) + 2 H2O(l)
CH4
(g) + 2 H2O(l) Esta reação, descoberta pelo químico francês Paul Sabatier, tem sido estudada para remover CO2 de atmosferas artificiais como em espaçonaves. Considerando que um indivíduo libere para o ambiente 0,6 kg de dióxido de carbono por dia, e que 80% desse gás será removido pelo processo de Sabatier, a massa de metano produzida por dia é de Dados: Massas Molares: H = 1g.mol-1 C = 12g.mol-1 O=16g.mol-1
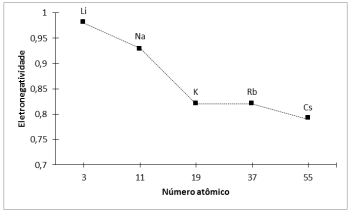
De acordo com os dados apresentados, o metal alcalino que estabelecerá com o flúor a ligação química de maior caráter iônico será o
I. Apresentam densidade elevada comparados com os metais, equivalente a 4,0 g/cm3 .
II. Apresentam elevados níveis de reatividade.
III. São bioacumulados.
IV. Organismos vivos podem degradá-los.
V. Possuem elevado número atômico.
Assinale a alternativa correta.
I. CaCO3 → CaO + CO2 II. C + O2 →CO2 III. 2NaI + Cl2 → 2NaCl + I2 IV. 2AgCl → 2Ag + Cl2 V. Fe + CuSO4 →FeSO4 + Cu
Assinale a alternativa correta:
