Questões de Concurso
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 1.169 questões
Sobre os metais e seus aspectos toxicológicos, é INCORRETO afirmar que
Para a remoção de cromo hexavalente (Cr6+) pode-se utilizar dióxido de enxofre (SO2). A redução do Cr6+ se dá em meio ácido com pH entre 2 e 3. Após a neutralização com hidróxido de cálcio [Ca(OH)2], em pH 8 a 9, o cromo precipita como hidróxido de cromo III (Cr(OH)3). As reações envolvidas são:
− Redução: 3 SO2 + 2 H2CrO4 + 3 H2O → Cr2(SO4)3 + 5 H2O
− Precipitação: Cr2(SO4)3 + 3 Ca(OH)2 → 2 Cr(OH)3 + 3 CaSO4
− Estequiometricamente é necessário na redução 2,0 g de SO2/g Cr6+ e de 2,0 g de H2SO4 / g Cr6+
− Na precipitação utiliza-se 2,6 g de Ca(OH)2 /g Cr6+
Para tratar um efluente de 8,0 m3 contendo 0,50 g de g Cr6+/L de efluente, o consumo de SO2, H2SO2 e Ca(OH)2 são, respectivamente:
O laboratório que está sujeito à norma na questão anterior é um gerador contínuo de resíduos de mercúrio. O tratamento adequado desses resíduos consiste na sua acidificação com ácido nítrico seguido da adição de tioacetamida (CH3SNH2). Esse último sofre decomposição, gerando íons sulfeto em meio ácido.
Dados: M (g.mol-1 ): Hg = 200; S = 32; N = 14; H = 1; KPS: HgS = 2 x 10-53 .
Uma bombona de 20L contém um resíduo de mercúrio em concentração de 0,1 mol.L-1 . Qual é a massa (em gramas) mínima necessária de tioacetamida para tratar esse resíduo?
Os PCBs (policlorobifenil) foram extensivamente utilizados como materiais dielétricos e fluidos refrigerantes em transformadores, capacitores e motores elétricos, devido aos altos valores de capacidade calorífica e temperatura de ebulição. No entanto, os PCBs possuem alta toxicidade. O 3,3’,4,4’-tetraclorobifenil é um PCB bastante comum.
Dados: Cp, 298K: água = 4,18 J.g-1K-1 ; 3,3’,4,4’-tetraclorobifenil = 311 J.mol-1K-1 . M (g.mol-1 ): água = 18; 3,3’,4,4’- tetraclorobifenil = 292. Teb, 1atm (°C): água = 100; 3,3’,4,4’-tetraclorobifenil = 380.
Considerando a mesma quantidade de matéria entre a água e o 3,3’,4,4’-tetraclorobifenil, a variação de temperatura (em ºC) no PCB ao receber a quantidade de calor que provoca uma variação de temperatura de 80 °C na água é de:
Na figura ao lado estão ilustrados gráficos da variação de energia no decorrer da reação para três sistemas independentes: (I), (II) e (III). A e B são espécies distintas em cada caso.
Acerca do exposto, considere as afirmativas a seguir:
1. No caso (I), o excesso de energia é transferido para a vizinhança.
2. A curva (II) corresponde a uma reação isoergônica.
3. A reação (II) necessita da maior energia de ativação dos três casos.
4. A reação (III) pode ocorrer a temperatura ambiente.
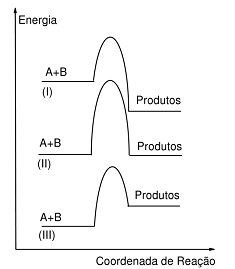
Assinale a alternativa correta.
A tabela periódica é dividida em grupos e períodos. As propriedades periódicas dos elementos são determinadas pela estrutura eletrônica do átomo. Sobre o assunto, considere as seguintes afirmativas:
1. O raio atômico num grupo de um metal de transição praticamente não varia entre átomos do quinto e sexto períodos.
2. A primeira energia de ionização de um átomo é maior que sua segunda energia de ionização.
3. A afinidade eletrônica do F (Z = 9) é maior que do Ne (Z = 10).
4. A eletronegatividade de um átomo do grupo II é menor que a de um átomo do grupo XV.
Assinale a alternativa correta.
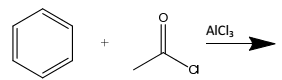
Assinale a alternativa que apresenta um produto da seguinte reação orgânica.
Propriedades periódicas são aquelas definidas na tabela periódica, conforme a variação do número atômico (Z) dos elementos químicos. Sobre o tema, marque V para as afirmativas verdadeiras e F para as falsas.
( ) A eletronegatividade diminui no período da esquerda para a direita e na família de baixo para cima.
( ) A eletroafinidade aumenta no período da esquerda para a direita e na família de cima para baixo.
( ) O potencial de ionização diminui no período da direita para a esquerda e na família de cima para baixo.
A sequência está correta em
O estudo da tabela periódica mostrou que um grande número de propriedades físicas e químicas variavam conforme a variação do número atômico dos elementos químicos. Estas propriedades são as chamadas propriedades periódicas. Assinale a alternativa INCORRETA acerca das propriedades periódicas.
(Considere apenas elementos neutros e desconsidere os íons.)
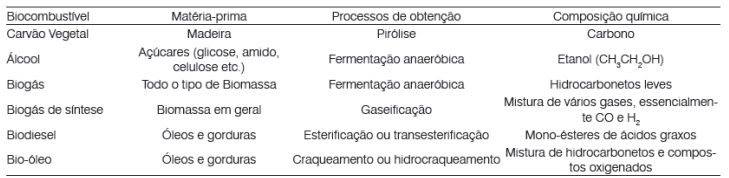
Principais exemplos de Biocombustíveis
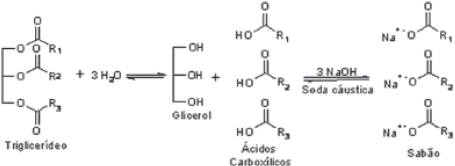
(Química Nova na Escola, n28, maio, 2008.)
A transformação de carbonato de cálcio em óxido de cálcio pode ser representada pela equação a seguir:
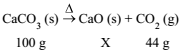
A massa, em gramas, correspondente a X é igual a