Questões de Concurso
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 1.107 questões
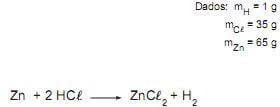

Qual a massa, em gramas, de gás carbônico que é produzida nessa reação se são consumidos 100 g de carbonato de cálcio?
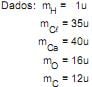
FeCl 3(aq) + NH4 OH(aq) → Fe(OH) 3(s) + NH4 Cl (aq)
Nessa transformação química, e de acordo com os símbolos e códigos da reação, observa-se que
Na reação de combustão do metano, qual é a quantidade de O2 (g), em mols, necessária para que 6 mols de CH4 (g) sejam completamente consumidos na reação, produzindo CO2 (g) e H2 O?
Reação 1:
2 Mg(s) + O2 (g) 2MgO(s): reação que acontece em flashes descartáveis de fotografia.
Reação 2:
2NaN3 (s) 3N2 (g) + 2Na(s): reação advinda do acionamento de dispositivos de segurança presentes nos automóveis, chamados airbags. A decomposição do NaN3 (s) origina N2 (g), que os faz inflar.
Reação 3:
Zn(s) + 2HC(aq) ZnC
 2 (aq) + H2 (g): reação que ocorre quando uma lâmina de zinco é colocada em uma solução aquosa de ácido clorídrico, havendo a formação do ZnC
2 (aq) + H2 (g): reação que ocorre quando uma lâmina de zinco é colocada em uma solução aquosa de ácido clorídrico, havendo a formação do ZnC 2 (aq) e gás hidrogênio.
2 (aq) e gás hidrogênio.Reação 4:
BaC
 2 (aq) + Na2 SO4 (aq) BaSO4 (s) + 2 NaC(aq): a reação de cloreto de bário com sulfato de sódio produz o cloreto de sódio e o sulfato de bário precipitado.
2 (aq) + Na2 SO4 (aq) BaSO4 (s) + 2 NaC(aq): a reação de cloreto de bário com sulfato de sódio produz o cloreto de sódio e o sulfato de bário precipitado. Após analisar essas reações, uma estudante de Química fez as seguintes afirmações:
I – As reações 1 e 3 são de “síntese”, e a reação 2 é de “decomposição”.
II – As reações 3 e 4 são, respectivamente, de “simples troca” e de “dupla troca”.
III – A reação 2 é de decomposição.
IV – A reação 1 é de síntese.
Com base na teoria das classificações das reações químicas, a estudante fez afirmações corretas APENAS em
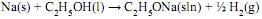
Para eliminar um resíduo de 230 mg de sódio, a massa necessária de etanol é, em miligramas, igual a
I - N2 e O2 não podem ser comprimidos até a liquefação.
II - N2 e O2 não são ?uidos, por serem gases razoavelmente inertes.
III - A densidade do ar é maior que a do nitrogênio nas condições normais de temperatura e pressão.
Dados
MO = 16 g mol -1
MN = 14 g mol -1 )
Está correto APENAS o que se afirma em
Dados
MO = 16 g mol -1
MN = 14 g mol -1
MH = 1 g mol -1
5H2 C2 O4 + 2KMnO4 + 6H+
→
10 CO2 + 2Mn2+ + 8H2 OO volume, em mL, de solução de KMnO4 0,165 mol/L, necessário para reagir com 108 mL de ácido oxálico, de igual concentração molar, é
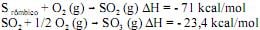
Considerando essas equações químicas, julgue os itens seguintes.
A reação global pode ser representada pela seguinte equação:
S rômbico + 3/2 O2 (g) → SO3 (g) ΔH = -94,4 kcal/mol.
Após a descoberta da radioatividade, foi possível identificar novos elementos da tabela periódica. O urânio, de número atômico 92, que era o elemento mais pesado na tabela, passou a ser seguido por outros elementos, denominados transurânicos.
Os elétrons do fósforo, elemento responsável pela fosforescência, podem realizar saltos quânticos, absorvendo luz ao retornar ao estado fundamental. Os tubos de raios catódicos, que utilizam material fosforescente, eram um dos componentes dos televisores antigos.

Sabendo-se que o número atômico do elemento químico fósforo é 15, é correto inferir que a camada de valência do átomo de fósforo na molécula de Sarin apresenta 10 elétrons.
H2 + 1/2 O2 → H2O
Nesse processo, quantos mols de O2 são necessários para produzir 10 mols de H2 O?
A decomposição de 2,27 g de nitroglicerina nas CNTPs produzirá, ao todo, aproximadamente ________ litros de gases. Assinale a alternativa que completa corretamente a lacuna da frase acima.