Questões de Concurso
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 1.107 questões
A massa de óxido de cálcio, em kg, e o volume de dióxido de carbono, em L, medidos nas condições normais de temperatura e pressão, produzidos pela pirólise de uma tonelada de carbonato com um grau de pureza de 50%, são, respectivamente, iguais a
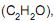 o volume de dióxido de carbono gasoso produzido, nas condições normais de temperatura e pressão, quando 126,0 gramas de etileno reagem com excesso de oxigênio, em L, é igual a
o volume de dióxido de carbono gasoso produzido, nas condições normais de temperatura e pressão, quando 126,0 gramas de etileno reagem com excesso de oxigênio, em L, é igual aPb(NO3)2(aq) + Na2SO4(aq) → PbSO4(s) + 2NaNO3(aq)
A quantidade máxima de sulfato de chumbo II que pode ser obtida a partir da reação de 6,62 g de Pb(NO3)2 com Na2SO4 em excesso é, aproximadamente, em g, igual a Dados: M(Pb(NO3)2) = 331 g/mol M(PbSO4) = 303 g/mol
I - O que caracteriza a reação, em meio aquoso, de um ácido com uma base é a formação de H2O.
II - O oxigênio nos peróxidos possui número de oxidação 1-, exceto no H2O2.
III - O dióxido de carbono, CO2é um óxido que reage com água, formando ácido carbônico.
É correto APENAS o que se afirma em
H2CrO4 + NaHSO3 + H2SO4 ? Cr2(SO4)3 + Na2SO4 + H2O
A soma dos coeficientes mínimos desta equação é:
(Dados: Massas molares em g/mol: H2SO4 = 98; NaOH = 40; Mg = 24; Ca = 40; Fe = 56; Zn = 65; Pb = 207)




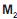 O e MO. Considere as afirmações abaixo sobre esse elemento e seus compostos.
O e MO. Considere as afirmações abaixo sobre esse elemento e seus compostos.I - O elemento M pertence ao grupo dos metais alcali- nos.
II - No composto MO, o oxigênio apresenta estado de oxidação -1.
III - O elemento M apresenta dois estados de oxidação.
IV - No composto
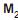 O, o oxigênio apresenta estado de oxidação -2.
O, o oxigênio apresenta estado de oxidação -2.São corretas APENAS as afirmativas
Um exemplo de danos materiais (e também culturais) causado pela chuva ácida ocorre na Grécia, onde diversos monumentos históricos feitos de mármore foram danificados, forçando o governo a trocar algumas esculturas por réplicas. Os principais agentes da chuva ácida são óxidos do nitrogênio e do enxofre. Considere que 3,20 g de enxofre foram queimados em excesso de gás oxigênio, originando o óxido onde o enxofre se encontra em seu maior estado de oxidação. Tal óxido foi recolhido em quantidade suficiente de água em um erlenmeyer onde foi introduzido um pedaço de mármore de 10,00 g. Se todas as etapas do processo apresentam rendimento de 100 %, e apenas 80,0 % do mármore é formado por carbonato de cálcio, ao final da última reação, a massa de gás liberada, em g, foi de
Uma definição muito comum e que possibilita tal medida é considerar que o raio atômico é a metade da distância entre os núcleos de átomos vizinhos de uma substância simples. Essa definição permite a determinação de raios atômicos para grande parte dos elementos, mas alguns deles não podem ter seus valores de raio determinados segundo essa metodologia, por não formarem substâncias simples com ligações entre os átomos. Um exemplo desses elementos é o
I – Adicionando-se HCl(aq) , ocorrerá evolução de H2(g) caso o sólido seja o carbonato de potássio.
II – Adicionando-se Na2S(aq) , ocorrerá precipitação, caso o sólido seja o cloreto de bário.
III – Adicionando-se H2O(l) e borbulhando-se CO2(g) , ocorrerá precipitação, caso o sólido seja óxido de sódio.
IV – Adicionando-se H2SO4(l) , ocorrerá evolução de ácido clorídrico, caso o sólido seja o cloreto de sódio.
Estão corretas APENAS as considerações
2KO2(s) + CO2(g) ? K2CO3(s) + 3/2 O2(g)
Se uma pessoa exala cerca de 1020,0 L de gás carbônico por dia, a quantidade de superóxido necessária para capturar todo o gás carbônico num período de três dias de viagem, em kg, é
Dado: Densidade do gás carbônico = 1,960 g/L