Questões de Concurso
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 1.169 questões
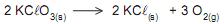
Sendo o volume molar igual 22,4 L/mol (na condição normal de temperatura e pressão), o volume máximo de oxigênio que pode ser obtido a partir da decomposição de 4,00 mol de KCLO3 , com o rendimento percentual de 90%, em L, é
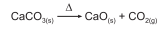
A quantidade máxima, em kg, de óxido de cálcio que se obtém a partir de 200 kg de calcário, contendo 90% em massa de carbonato de cálcio, é
Fe + O2 + H2O → Fe2+ + (OH)- → Fe(OH)2
Fe (OH)2 + O2 + H2O → Fe (OH)3
Sabe-se que, para um gás ideal, 1 mol equivale a 6,02 x 1023 moléculas e 22,4 L nas CNTP. Após realizar o correto balanço das equações desse processo corrosivo, conclui-se que, para produzir 10 mols de Fe (OH)3, nas CNTP, é necessário consumir

Sobre esses elementos, considere as afirmativas a seguir.
I – A quarta camada do elemento M está completamente preenchida.
II – J, Q e M são metais alcalinos.
III – X é um metal do grupo do carbono.
IV – Q e X são do mesmo período da Tabela Periódica.
Estão corretas APENAS as afirmativas
LAVOISIER, A.L. Tratado Elementar de Química. São Paulo: Madras, 2007, p. 162.
Já no final do séc. XVIII, Lavoisier utilizou uma linguagem química que nos é muito familiar atualmente. No trecho acima, ele descreve, por exemplo, a reação química entre o carbonato de cálcio (presente no mármore) e o ácido sulfúrico. Essa reação está corretamente representada em
A reforma catalítica do heptano pode ser descrita, de maneira simplificada, pela seguinte equação química não balanceada:
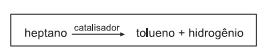
Utilizando-se estruturas químicas, essa reação fica corretamente descrita em
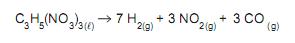
Essa reação química é identificada como
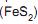 , galena (PbS) esílica(SiO2) , além de outros minerais, e possui a seguinte composição: 50% de Zn, 32% de S, 8% de Fe, 1% de Si, 0,2% de Cd. O tratamento envolve ustulação, lixiviação do zinco, purificação da solução e eletrorredução do metal, com a obtenção de ácido sulfúrico como subproduto. Que quantidade, em kg, de ácido sulfúrico 98% é obtida para cada tonelada de zinco produzido?
, galena (PbS) esílica(SiO2) , além de outros minerais, e possui a seguinte composição: 50% de Zn, 32% de S, 8% de Fe, 1% de Si, 0,2% de Cd. O tratamento envolve ustulação, lixiviação do zinco, purificação da solução e eletrorredução do metal, com a obtenção de ácido sulfúrico como subproduto. Que quantidade, em kg, de ácido sulfúrico 98% é obtida para cada tonelada de zinco produzido?
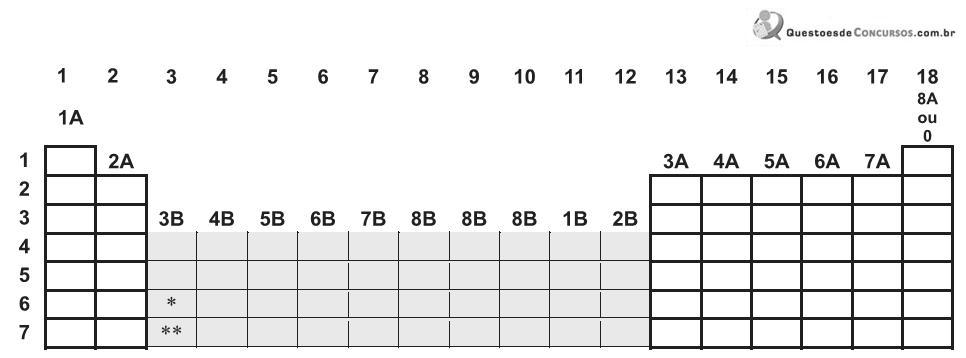
Analisando o esboço da tabela periódica e a posição de cada elemento nos espaços em branco e sabendo que há uma relação entre a posição do elemento e a distribuição dos seus elétrons em subníveis e níveis na camada de valência, está INCORRETO afirmar que os átomos dos elementos situados no
Com base na distribuição dos elementos na tabela, em grupos e períodos, pode-se prever e afirmar que a(o)

Com base nessas informações, julgue os itens que se seguem.
Os complexos de metais de transição com configuração eletrônica d9 , tais como o complexo
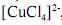 , caracterizam-se pela geometria quadrado planar.
, caracterizam-se pela geometria quadrado planar. 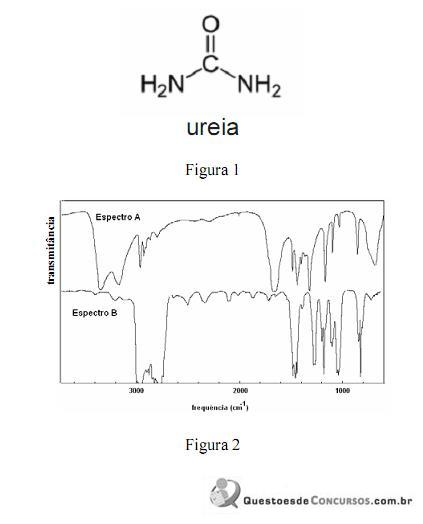
A amônia serve como substrato para a síntese de um grande número de substâncias, como aminas e amidas. Merece destaque a ureia, que é largamente empregada como fertilizante e cuja estrutura é apresentada na figura 1. Na figura 2, são apresentados os espectros de infravermelho de duas outras substâncias que podem ser sintetizadas a partir da amônia: a propanamida e a trietilamina, sendo que os espectros não estão apresentados, necessariamente, nessa ordem. Com relação aos derivados da amônia citados e aos espectros apresentados, julgue os itens que se seguem.
A reação da amônia com a propanona resulta na formação da etanamida.
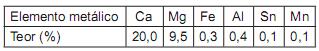
Um recurso empregado para controlar a emissão de poluentes consiste na adição de calcário ao leito fluidizado em que se queimam carvões contendo enxofre. Considerando-se o uso de um calcário dolomítico com a composição indicada acima, qual a quantidade estequiométrica, em kg, a ser utilizada por tonelada de carvão no caso de um combustível com 1,6% de enxofre (S)?
Dado: Leve em conta apenas o óxido de cálcio na eficiência do processo.
Os resultados empíricos fornecidos pelas leis dos gases sugeriram um modelo em que o gás ideal é formado por moléculas amplamente espaçadas, que não interagem entre si e que estão em movimento incessante e com velocidades médias que aumentam com a temperatura. Com relação a esses resultados, assinale a alternativa correta.
As propriedades da matéria são o objeto de toda a química, particularmente a conversão de uma forma de matéria em outra. Acerca desse assunto, assinale a alternativa correta.
Texto VII, para responder às questões 34 e 35.
Uma explosão em uma plataforma petrolífera transformou as águas do mar do Golfo do México, nos Estados Unidos da América, no cenário de uma tragédia ambiental. Milhares de toneladas de petróleo despejadas ameaçam a existência de mais de 600 espécies de seres vivos. As consequências para a vida na região demorarão décadas para serem superadas.
Anos de prejuízo. Ciência. In: Correio Braziliense,
13/6/2010, p. 26 (com adaptações).
O conhecimento acerca das etapas de dissipação do petróleo derramado no mar é essencial para a amenização da tragédia ambiental. Entre as etapas de dissipação apresentadas no texto VII, aquelas em que efetivamente ocorrem reações químicas são